| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》在线测试(2017年最新版)(十)
参考答案:D 本题解析:NaF是强碱弱酸盐,水解显碱性,溶液中有H2O和HF两种分子。NH4Cl是强酸弱碱盐,水解显酸性,溶液中有H2O和NH3·H2O两种分子。HClO是弱酸,存在电离平衡,溶液中有H2O和HClO两种分子。硝酸是强酸,在溶液中全部电离,只有水分子。所以答案选D。 本题难度:一般 2、填空题 I.利用含锰废水(主要含Mn2+、SO 参考答案:I.(1)Fe(OH)3,Al(OH)3 本题解析:I.(1)调节pH在5.2,由题意知Fe2+和Al3+均以Fe(OH)3和Al(OH)3沉淀状态存在;(2)加入MnS是为了使其中Cu2+产生CuS沉淀除去,故搅拌目的是使MnS 与 Cu2+快速、充分反应,离子方程式MnS + Cu2+ = Mn2+ + CuS↓;(3)由题意知Mn2+和加入的HCO3-反应,产生CO2气体和MnCO3沉淀,故离子方程式Mn2++2HCO3- =MnCO3 +CO2↑+H2O;(4)MnCO3受热分解为MnO,MnO部分氧化为MnO2,产品中杂质有MnO,460.0 gMnCO3,物质的量为4mol,受热产生4molMnO,设产生MnO2物质的量为xmol,即有xmolMnO氧化,剩余MnO为(4-x)mol,产物的总质量为(4-x)mol×71g·mol-1+xmol×87g·mol-1=332g,x=3,则MnO2的质量分数= 本题难度:困难 3、选择题 已知同温度下,三种酸的电离平衡常数的大小关系为Ka(HX)>Ka(HY)>Ka(HZ),则物质的量浓度相同的三种盐NaX、NaY和NaZ溶液pH由大到小的顺序是 |
参考答案:D
本题解析:
试题解析:酸性越弱,相应的钠盐越容易水解,碱性越强,PH越大,故三种盐NaX、NaY和NaZ溶液pH由大到小的顺序是NaZ、NaY、NaX。
考点:盐类水解的规律
本题难度:一般
4、选择题 下列液体均处于25°C,有关叙述正确的是
A.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
B.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
C.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中的100倍
D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-)
参考答案:C
本题解析:A、在同浓度的CaCl2和NaCl溶液中,铝离子浓度较大,对氯化银的溶解起到了抑制作用,所以AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不相同,错误;B、pH<7的溶液有可能是酸,强酸弱碱盐或者强酸的酸式盐,错误;C、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中的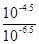 =100倍,正确;D、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(CH3COO-)>c(Na+),错误;故本题选择C。
=100倍,正确;D、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(CH3COO-)>c(Na+),错误;故本题选择C。
考点:难溶电解质的溶解平衡,pH的基本计算,离子浓度的比较
本题难度:一般
5、选择题 在Na2S溶液中下列关系不正确的是( )
A.c(Na+)=2c(HS-)+c(S2-)+c(H2S)
B.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
C.c(Na+)> c(S2-)>c(OH-)>c(HS-)
D.c(OH-)=c(HS-)+c(H+)+2c(H2S)
参考答案:A
本题解析:A、Na2S溶液中物料守恒式应为:c(Na+)=2c(HS-)+2c(S2-)+2c(H2S),错误; B、c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)为Na2S溶液中的电荷守恒式,正确;C、c(Na+)> c(S2-)>c(OH-)>c(HS-),正确;D、c(OH-)=c(HS-)+c(H+)+2c(H2S) 为Na2S溶液中的质子守恒式,正确。
考点:考查电解质溶液中的离子浓度关系、三个守恒式。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《有机合成与推断》.. | |