微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)有A、B、C、D四种化合物,分别由K+、Ba2+、SO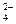 、CO
、CO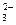 、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。请回答:
、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。请回答:
(1)写出化学式:A?; C?;D?;
(2)写出下列反应的离子方程式。
B与盐酸反应? _______________________
E与过量的澄清石灰水反应? ___________________________
参考答案:
小题1:A? BaSO4?__; ?C? Ba(OH)2 ?; D? K2CO3 ?
小题2:BaCO3 + 2H+?= Ba2+ ?+ H2O +CO2↑
? CO2?+ Ca2+? + 2OH-? ="?" CaCO3↓ + H2O?
本题解析:略
本题难度:简单
2、实验题  某研究性小组借助A-D的仪器装置完成有关实验
某研究性小组借助A-D的仪器装置完成有关实验


 【实验一】收集NO气体。
【实验一】收集NO气体。
(1)? 用装置A收集NO气体,正确的操作上?(填序号)。
用装置A收集NO气体,正确的操作上?(填序号)。
 a.从①口进气,用排水法集气? b.从①口进气,用排气法集气
a.从①口进气,用排水法集气? b.从①口进气,用排气法集气
 c.从②口进气,用排水法集气? d..从②口进气,用排气法集气
c.从②口进气,用排水法集气? d..从②口进气,用排气法集气
 【实验二】为了探究镀锌薄铁板上的锌的质量分数
【实验二】为了探究镀锌薄铁板上的锌的质量分数 和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
 方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究木目标。
 (2)选用B和?(填仪器标号)两个装置进行实验。
(2)选用B和?(填仪器标号)两个装置进行实验。
 (3)测得充分反应后生成氢气的体积为VL(标准状况),
(3)测得充分反应后生成氢气的体积为VL(标准状况), =?。
=?。
 (4)计算镀层厚度,还需要检索的一个物理量是?。
(4)计算镀层厚度,还需要检索的一个物理量是?。
 (5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。
 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g 。
 (6)
(6) ?。
?。
 方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
 (7)从实验误差角度分析,方案丙?方案乙(填“优于”、“劣于”或“等同于”)。
(7)从实验误差角度分析,方案丙?方案乙(填“优于”、“劣于”或“等同于”)。
参考答案: (1)C? (2)D? (3)
(1)C? (2)D? (3)  (或
(或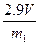 等其他合理答案)
等其他合理答案)
 (4)金属锌的密度(或其他合理答案)
(4)金属锌的密度(或其他合理答案)
 (5)偏大
(5)偏大
 (6)
(6)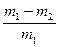 (或其他合理答案)
(或其他合理答案)
 (7)劣于
(7)劣于
本题解析:(1)NO遇空气立即被氧化,故不能用排空气法收集,只能用排水法收集。排水时应用短进长出。(2)方案甲:Zn和Fe中只有Zn可以与NaOH产生气体,通过排水收集气体,依据反应方程式即可算出Zn的质量分数。所以需要的装置有测H2的体积的D装置。(3)Zn与H2之间量为1:1,则n(Zn)="V/22.4" mol,w (Zn)=m(Zn)/m1 =  。(4)有了Zn的质量,如果有密度,则可以求出Zn的体积,再由Zn的截面积,即可求出Zn的高度(厚度)。(5)恒压式分液漏斗产生的气体有部分残留在分液漏斗上方,故排气时收集少了,所以用普通漏斗时收集的H2多一些,则计算出的Zn的量偏大。(6)减少的质量即为Zn的质量。(7)丙方案根据H2的质量差值,显然误差大,因为产生的H2质量很小,计算偏差大。
。(4)有了Zn的质量,如果有密度,则可以求出Zn的体积,再由Zn的截面积,即可求出Zn的高度(厚度)。(5)恒压式分液漏斗产生的气体有部分残留在分液漏斗上方,故排气时收集少了,所以用普通漏斗时收集的H2多一些,则计算出的Zn的量偏大。(6)减少的质量即为Zn的质量。(7)丙方案根据H2的质量差值,显然误差大,因为产生的H2质量很小,计算偏差大。
本题难度:一般
3、填空题 锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
(1)锌锰干电池的负极电极反应式是______,电路中每通过0.4mole-,负极质量减少______g;工作时NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是______.
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验

已知:Zn(OH)2是两性氢氧化物.完成下列实验报告:
| 实验步骤 | 实验现象 | 实验结论
①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量.
生成白色沉淀,______
无色溶液中
存在Zn2+离子
②______
______
无色溶液中
存在NH4+离子
|
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如图3所示.将等物质的量浓度、等体积H2O2溶液加入分液漏斗中,分别进行2个实验(气体的体积在相同条件下测定).
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释
实验一
足量MnO2
收集到56mL气体
MnO2做催化剂
实验二
足量MnO2
和稀硫酸
黑色粉末部分溶解,
收集到112mL气体
______
______
|
①实验一、二中参加反应的H2O2的物质的量之比为______;
②实验二中反应的离子方程式为______;
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意______.
参考答案:(1)锌锰干电池的负极上Zn失去电子,负极反应为Zn-2e-═Zn2+,负极消耗1mol时转移2mol电子,每通过0.4mole-,负极质量减少0.2mol×65g/mol=13.0g,由NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒为氨气,另一种为氢气,正极反应为2NH4++2e-═2NH3↑+H2↑,
故答案为:Zn-2e-═Zn2+;13.0;2NH4++2e-═2NH3↑+H2↑;
(2)①无色溶液中含Zn2+、NH4+,加碱均发生反应,先生成的白色沉淀能溶解在强碱溶液中,铵根离子与碱反应生成有刺激性气味的气体为氨气,
故答案为:白色沉淀逐渐溶解,产生刺激性气味的气体;
②检验生成的氨气,则将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口,观察到红色石蕊试纸变蓝,证明含铵根离子,
故答案为:将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口;红色石蕊试纸变蓝;
(3)黑色粉末部分溶解,则二氧化锰反应生成锰离子,Mn元素的化合价降低,则MnO2做氧化剂,生成Mn2+离子,故答案为:MnO2做氧化剂;生成Mn2+离子;
①等物质的量浓度、等体积H2O2溶液加入分液漏斗中,实验一中过氧化氢既是氧化剂又是还原剂,实验二中H2O2是还原剂,由氧气的体积1:2可知,等物质的量的过氧化氢均完全反应,则参加反应的H2O2的物质的量之比为1:1,故答案为:1:1;
②实验二中反应生成锰离子、水、氧气,离子反应为H2O2+2H++MnO2═Mn2++2H2O+O2↑,故答案为:H2O2+2H++MnO2═Mn2++2H2O+O2↑;
③测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,要注意上下移动B管,使A、B两管中液面相平,故答案为:上下移动B管,使A、B两管中液面相平.
本题解析:
本题难度:一般
4、填空题 两个学习小组用如图装置(固定装置及胶皮管略去)探究乙二酸(HOOC—COOH)受热分解的部分产物。己知常温时CO+PdCl2+H2O==CO2↑+Pd↓(灰)+2HCl
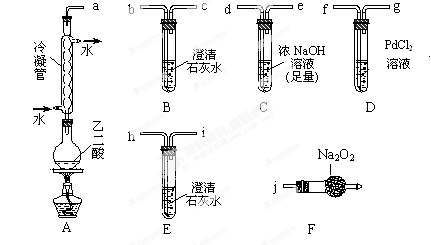
(1)甲组:
①按接口顺序:a-b-c-d-e-f-g-h连接装置进行实验。B中溶液变浑浊,证明分解产物有?; E中溶液变浑浊,证明分解产物有?。
②乙二酸受热分解的化学方程式为?。
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为?。
②去掉冷凝管,将接口a与b连接进行实验, B中溶液变浑浊,但不能说明有欲检验的一种分解产物,理由为?。
参考答案:( 8分)(1)①CO2; CO。?②HOOC—COOH CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
(2)①2Na2O2+2CO2=2Na2CO3+O2?②草酸会和石灰水产生浑浊
本题解析:(1)①B中澄清石灰水变浑浊,证明分解产物有CO2产生;装置C的作用是充分除去CO2,防止对后继实验产物检验的干扰;E中澄清石灰水变浑浊,说明有CO2产生,乙二酸产生的CO2在C装置中已经被NaOH吸收完全,CO2的产生来源于D装置中高锰酸钾对CO的氧化,D中现象为溶液褪色(或变浅),证明分解产物有CO。
②乙二酸受热分解的化学方程式为HOOC—COOH CO2↑+CO↑+H2O。
CO2↑+CO↑+H2O。
(2)①接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,说明有氧气产生,通过冷凝管后出来主要是CO2,CO2与Na2O2反应的化学方程式为:2CO2+Na2O2=2Na2CO3+O2。
②由于草酸易挥发,则去掉冷凝管,将接口a与b连接进行实验,将导致挥发出的草酸和石灰水反应生成难溶性的草酸钙而变混浊,所以不能说明。
点评:该题是高考中的常见题型,属于中等难度的试题。做题时注意除杂问题,特别是物质检验时要排除其它物质的性质干扰,以得出正确结论。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
5、选择题 下列实验方案中,不能达到实验目的的是
选项
| 实验目的
| 实验方案
|
A
| 检验CH3CH2Br在NaOH溶液中是否发生水解
| 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液用稀HNO3酸化加入AgNO3溶液,观察是否产生淡黄色沉淀
|
B
| 检验Fe(NO3)2晶体是否已氧化变质
| 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红
|
C
| 验证Br2的氧化性强于I2
| 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色
|
D
| 验证Fe(OH)3的溶解度小于Mg(OH)2
| 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色
参考答案:B
本题解析:A、溴乙烷在氢氧化钠的溶液中加热发生水解生成乙醇、溴化钠。在酸性条件下溴化钠与硝酸银溶液反应产生淡黄色沉淀溴化银,能达到实验目的,A正确;B、在酸性条件下,NO3-具有氧化性,能把Fe2+氧化生成铁离子,铁离子与KSCN溶液发生显色反应,溶液显红色,不能达到实验目的,B不正确;C、下层液体呈紫色,说明反应中有碘生成,即溴与碘化钾发生了置换反应生成了碘和溴化钾,这说明溴的氧化性强于碘的氧化性,C正确;D、将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色,说明反应中有氢氧化铁生成。根据沉淀容易向更难溶的方向转化可知Fe(OH)3的溶解度小于Mg(OH)2的溶解度,D正确,答案选B。
本题难度:一般
|