微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (8分)文献资料显示,草木灰主要含有不溶性杂质及K2CO3,还含有少量KCl、K2SO4等。某化学兴趣小组拟测定草木灰中钾盐的含量及钾盐中K2CO3的含量。
测定草木灰中钾盐含量
(1)该实验的主要步骤顺序为:称量→?→?→?→ ?→冷却→再称量(填字母序号)
A. 溶解? B.过滤? C、洗涤、烘干? D、蒸发
(2)称量前,在调整托盘天平的零点时,若指针偏向右边,应将右边的螺丝向?(填左、右)旋动。某学生称量时,在天平右盘加上规定质量的砝码后,在左盘的小烧杯中加入样品,此时指针稍偏右边,该学生的操作应为?。
(3)实验中A、B、C、D三步操作均使用了玻璃棒,操作B中玻璃棒的作用是?,操作D用玻璃棒不断搅动的原因?。
测定钾盐中K2CO3含量
(4)取上述操作中所得的钾盐,配成稀溶液,加入CaCl2溶液使CO32-生成沉淀,过滤得到碳酸钙沉淀后,用蒸馏水多次洗涤,烘干、称量、计算。检验沉淀是否完全的方法是?,检验沉淀是否洗净的方法是?。
参考答案:(8分)
(1)ABDC(2分)(颠倒不得分)
(2)左(1分),继续往左盘小烧杯中慢慢加少量样品,使指针指向标尺中间,直至天平平衡(1分)
(3)引流(1分)?防止液体局部过热,液滴溅出(1分)?
(4)沉淀后静置,向上层清液中加入CaCl2溶液,观察是否有沉淀生成,若无沉淀生成,则说明沉淀完全,反之则沉淀不完全。(1分)取最后一次洗涤液少许,滴入数滴K2CO3溶液(或AgNO3溶液等也可),若无沉淀产生,即沉淀洗涤干净。(1分)
本题解析:略
本题难度:简单
2、填空题 某校学生课外活动小组的同学设计下图甲所示实验装置,用来验证一氧化碳具有还原性.
回答下列问题.
(1)写出装置A中发生反应的离子方程式______
(2)装置B中最适宜的试剂是______.
(3)装置D中黑色固体为______(填名称),反应的化学方程式为______.
(4)按照如图装置进行实验时,首先进行的操作是______
(5)根据实验中的______现象,可证明CO具有还原性,有关反应的化学方程式是______.
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置______与______之间连接下图乙中的______装置(填序号).

参考答案:(1)装置A中是盐酸和石灰石反应生成二氧化碳、氯化钙和水,其反应离子方程式为:CaCO3+2H+═Ca2++H2O+CO2↑;故答案为:CaCO3+2H+═Ca2++H2O+CO2↑;
(2)实验室用盐酸和石灰石制取二氧化碳,该反应放出的热量导致盐酸挥发,所以制取的二氧化碳中含有氯化氢气体,为除去氯化氢气体,选取的试剂应能除去氯化氢气体且不和二氧化碳反应,则只能选取可溶性的饱和碳酸氢盐,一般常用饱和的碳酸氢钠溶液,故答案为:饱和碳酸氢钠溶液;
(3)高温条件下,二氧化碳和碳反应生成一氧化碳,所以D装置中的黑色固体是炭,反应方程式为:CO2+C高温.2CO,
故答案为:炭;CO2+C高温.2CO;
(4)在做与气体有关的实验操作时,连接完仪器以后,加药品前,首先要检验装置的气密性,以免装置气密性不好,气体泄漏污染空气,故答案为:检查装置的气密性;
(5)一氧化碳具有还原性,所以能还原黑色的氧化铜,使其变为红色的铜单质,所以E中的现象是:黑色固体变为红色,反应方程式为:CO+CuO△.Cu+CO2,
故答案为:E中黑色固体变红;CO+CuO△.Cu+CO2;
(6)和二氧化碳的反应中,二氧化碳不可能完全转化为一氧化碳,所以从D装置出来的气体中含有二氧化碳,为防止原来二氧化碳的干扰,应先把D出来的二氧化碳除去,再将一氧化碳气体通过E装置,二氧化碳是酸性氧化物,所以用碱性物质除去,所以选②,
故答案为:D;E;②.
本题解析:
本题难度:一般
3、简答题 铬是一种银白色的坚硬金属.铬的工业用途很广,主要有金属加工、电镀、制革行业,这些行业排放的废水和废气是环境中的主要污染源.请回答下面与铬有关的一些问题.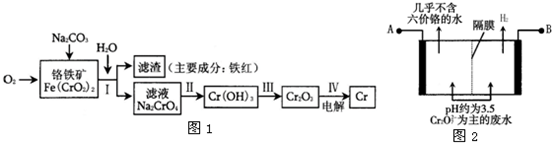
(1)工业上冶炼铬的主要步骤如图1所示:
①已知步骤Ⅱ的反应方程式为:
8Na2CrO4+6Na2S+23H2O═8Cr(OH)3↓+3Na2S2O3+22NaOH
该反应中每生成lmol Cr(OH)3时转移电子的物质的量为______mol;
②步骤IV中电解Cr2O3的阳极反应式为______.
(2)某工厂采用电解法处理含铬废水.耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,其原理示意图如图2.阳极区溶液中发生的氧化还原反应为:______.
(3)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作实验室制备纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取重铬酸铵.实验步骤如下:
步骤1:将铬酸钠溶于适量水中,加一定量浓硫酸酸化,使铬酸钠转化为重铬酸钠.
步骤2:先将上述溶液蒸发结晶并趁热过滤,继续将得到的晶体再溶解再蒸发结晶并趁热过滤.然后将得到的滤液冷却至40℃左右进行结晶,用水洗涤,获得重铬酸钠晶体.
步骤3:将得到的重铬酸钠和氯化铵按物质的量之比1:2溶于适量的水,加热至105~110℃时让其充分反应.
①步骤1是一个可逆反应,该反应的离子方程式为:______.
②(NH4)2Cr2O7受热分解制取N2及Cr2O3的化学方程式为:______.
③为了测定实验制得的产品中(NH4)2Cr2O7的含量,称取样品0.140g置于锥形瓶中,加50mL水;再加入2gKI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min;然后加150mL蒸馏水并加入3mL0.5%淀粉溶液;用0.1000mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL.则该产品中(NH4)2Cr2O7的纯度为.(假定杂质不参加反应,已知:Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,I2+2S2O32-═2I-+S4O62-)
参考答案:(1)①Cr元素的化合价由+6价变为+3价,该反应中每生成lmol Cr(OH)3时转移电子的物质的量=1mol×(6-3)=3mol,故答案为:3;
②电解熔融状态的Cr2O3,阳极上氧离子失电子生成氧气,阴极上铬离子得电子发生还原反应,所以阳极上电极反应式为:2O2--4e-=O2↑,故答案为:2O2--4e-=O2↑;
(2)阳极上铁失电子生成亚铁离子进入溶液,Cr2O72-具有强氧化性,能氧化亚铁离子生成铁离子,自身被还原生成铬离子,所以离子反应方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(3)①酸性条件下,CrO42-和氢离子反应生成Cr2O72-,离子方程式为:2CrO42-+2H+?Cr2O72-+H2O,故答案为:2CrO42-+2H+?Cr2O72-+H2O;
②在加热条件下,(NH4)2Cr2O7分解生成N2及Cr2O3,同时还生成水,则该反应方程式为:(NH4)2Cr2O7△.Cr2O3+N2↑+4H2O,
故答案为:(NH4)2Cr2O7△.Cr2O3+N2↑+4H2O;
③根据Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,I2+2S2O32-═2I-+S4O62-得关系式Cr2O72-----6S2O32-,
设Cr2O72-的物质的量为x,
Cr2O72-----6S2O32-,
1 6
x 0.1000mol/L×0.03L
1:6=x:(0.1000mol/L×0.03L)
x=0.0005mol,
根据原子守恒得n(Cr2O72-)=n((NH4)2Cr2O7),则m((NH4)2Cr2O7)=0.0005mol×252g/mol=0.126g,
其质量分数=0.126g0.140g×100%=90%,故答案为:90%.
本题解析:
本题难度:一般
4、选择题 某同学做麦芽糖的还原性实验,取4 mL 0.5mol·L-1的CuSO4溶液和4 mL 0.5 mol·L-1的NaOH溶液,将它们混合后,滴入1.0 mL的10%麦芽糖溶液,加热煮沸,结果没有看到红色沉淀生成,这是因为?(?)
A.麦芽糖溶液太浓
B.加热时间不够
C.CuSO4溶液不够量
D.NaOH溶液不够量
参考答案:D
本题解析:略
本题难度:简单
5、实验题 (14分)某研究性学习小组将一定浓度的Na2CO3?溶液滴入CuSO4溶液中得到沉淀。
甲同学认为两者反应只有CuCO3一种沉淀生成;
乙同学认为这两者相互促进水解反应,生成Cu(OH) 2一种沉淀;
丙同学认为生成CuCO3和Cu(OH) 2两种沉淀。
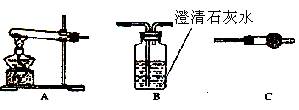
(1)各装置连接顺序为 ?→??→ ?。
(2)若甲同学的结论正确,实验现象为 ?。
II.若CuCO3和Cu(OH)2两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。

(1)仪器组装好后首先要进行的实验操作是 ?,实验结束时要继续通入处理过的过量空气,其作用是?。
(2)若沉淀样品的质量为mg,当反应完全后,装置C质量增加了ng,则沉淀中CuCO3的质量分数为?。
III.沉淀转化在生产中也有重要应用。例如,用Na2CO3溶液可以将锅炉水垢中的CaSO4转化为较疏松瓶易清除的CaCO3,该沉淀转化达到平衡时,其平衡常数K=___________(写数值)。[已知Ksp(CaSO4)=9.1×10—6,Ksp(CaCO3)=2.8×10—9]
IV.蓝铜矿的主要成分为2CuCO3·Cu(OH)2,当它与焦炭一起加热时,可以生成铜、二氧化碳和水,写出该反应的化学方程式_____________________________________________
参考答案:I、⑴A→C→B? ⑵C中无水硫酸铜不变色, 装置B中澄清石灰水变浑浊?
Ⅱ.⑴检查装置的气密性? ⑵可以将装置中滞留的水蒸气和CO2排出,使其分别被浓硫酸和碱石灰充分吸收。⑶1-49n/9m
Ⅲ.3.25×103
IV.2[2 CuCO3·Cu(OH)2]+3C=7CO2+6Cu+2H2O
本题解析:I.请用下图所示装置,选择必要的试剂,利用以下装置完成简单的定性探究生成物的成分的实验。I(1)沉淀加热分解的气体为H2O和CO2,C中干燥管吸收H2O,B中澄清石灰水吸收CO2,因澄清石灰水中含有水份,所以先吸收H2O后吸收CO2,故各装置连接顺序为A→C→B。(2)CuCO3加热分解生成的气体只有CO2,故实验现象为:C中无水硫酸铜不变色, 装置B中澄清石灰水变浑浊。
II(2)若沉淀样品的质量为m克,装置B质量增加了n克,应为水的质量,发生:Cu(OH)2 CuO+H2O,
CuO+H2O,
Cu(OH)2 CuO+H2O
CuO+H2O
98g ?18g
m(Cu(OH)2) ng
m(Cu(OH)2) ,
,
m(CuCO3) ,
,
ω(CuCO3) =1-49n/9m,
=1-49n/9m,
则沉淀中CuCO3的质量分数为1-49n/9m,
故答案为:1-49n/9m。
点评:本题考查化学反应机理的探究,题目难度中等,本题注意根据物质的化学性质设计实验方案,易错点为Ⅲ,注意实验时要排除空气中水和二氧化碳的干扰。
本题难度:困难