|
高考化学知识点总结《物质组成与性质实验方案的设计》在线测试(2017年最新版)(四)
2017-07-10 18:53:37
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (共3分)下列有关实验的叙述,不正确的是(填序号)?。
A.配制500 mL某物质的量浓度的溶液,可用两只250 mL的容量瓶
B.用渗析法分离淀粉中混有的NaCl杂质
C.用酸式滴定管量取20.00mL高锰酸钾溶液
D.在C2H5Cl与NaOH溶液共热的混合物中,加入AgNO3溶液即可检验氯元素
| E.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要三次
F.在氢氧化铁胶体中加入少量硫酸会产生沉淀
G.用结晶法可以除去硝酸钾中混有的少量氯化钠
参考答案:
本题解析:略
本题难度:一般
2、选择题 下列实验操作中,错误的是
A.制取蒸馏水时,为防止烧瓶内产生暴沸现象,应事先向烧瓶中加入几片碎瓷片
B.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2—3次
C.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
D.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
参考答案:C
本题解析:A 正确,加入碎瓷片,会防止暴沸
B 正确,用标准液酸滴定未知NaOH溶液,所以用酸式滴定管装酸,在用之前,除用水洗外,还要用标准酸液润洗2—3次
C 错误,配置硫酸溶液时,应在烧杯中稀释,冷却后再在容量瓶中定容
D 正确,不慎碰翻酒精灯失火,应立即用湿布盖灭
本题难度:一般
3、填空题 “化学多米诺实验”是利用化学反应中气体产生的压力,使多个化学反应依次发生.如图所示就是一个“化学多米诺实验”,其中A~F装置中分别盛放的物质为:A、稀硫酸;B、锌粒;C、某溶液;D、CaCO3固体;E、滴有紫色石蕊试液的蒸馏水;F、足量的澄清石灰水请回答下列问题:
(1)反应开始后,若E中出现红色,F中有白色沉淀生成,则C中的物质可能是______.
(2)装置D中的离子方程式______,该反应的类型是______,装置F中的离子方程式______.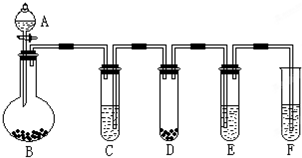
参考答案:“化学多米诺实验”是利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只需要控制第一个反应.
(1)应开始后,若E中滴有紫色石蕊试液的蒸馏水出现红色,说明有酸性气体生成;F中足量的澄清石灰水有白色沉淀生成,气体可能为二氧化碳或二氧化硫等,因为D中是碳酸钙固体,F中是澄清石灰水,所以该气体只能是二氧化碳,稀盐酸和稀硝酸都可和碳酸钙反应生成二氧化碳,所以C中的物质可能是稀盐酸或稀硝酸,
故答案为:稀盐酸或稀硝酸;
(2)碳酸钙和酸反应生成钙离子、水和二氧化碳,碳酸钙、水和二氧化碳写化学式,所以装置D中的离子方程式离子方程式为:CaCO3+2H+═Ca2++H2O+CO2↑;该反应是酸和盐反应生成另外的酸和盐,所以是复分解反应;二氧化碳使澄清的石灰水变浑浊,二氧化碳和氢氧化钙反应生成碳酸钙和水,所以装置F中反应的离子方程式为CO2+Ca2++2OH-═CaCO3↓+H2O
故答案为:CaCO3+2H+═Ca2++H2O+CO2↑;复分解反应;CO2+Ca2++2OH-═CaCO3↓+H2O.
本题解析:
本题难度:一般
4、选择题 下列化学实验或操作能够达到目的的是
A.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
B.欲除去蛋白质溶液中的NaCl而又不改变其性质,可加入适量BaCl2溶液后过滤
C.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
D.为了证明焦炉气中含有氢气,可将焦炉气通过灼热的氧化铜粉末,看黑色粉末是否变红色
参考答案:A
本题解析:A中氢氧化钠和氯化钾不反应,和氯化铝反应生成白色沉淀,氢氧化钠过量时沉淀又溶解。和氯化镁反应生成白色沉淀,氢氧化钠过量时,沉淀不溶解,可以鉴别,A正确;B中氯化钡是重金属盐,能使蛋白质变性,而变性是不可逆的,达不到提纯的目的,B不正确;氯水具有强氧化性,能使Ph试纸氧化而褪色,不能测定其pH值,C不正确;焦炉气中还含义CO,CO也具有还原性,能把氧化铜还原生成单质铜,D不正确,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。侧重对学生实验能力的考查,有利于培养学生规范、严谨的实验设计能力,也有助于培养学生的灵活应变能力。化学实验基本操作,是高考中的热点和重点,需要平时注意知识的积累和总结,该题的易错点是选项C。
本题难度:简单
5、简答题 锗(Ge)是第ⅣA族元素,它的单质是一种良好的半导体材料,被广泛地应用在电子工业上,锗可以从烟道灰中提取,其过程如下:

(1)写出上述各步反应的化学方程式①______;②______;③______;④______.
(2)提取过程中①至③的作用是什么?从节约资源角度考虑哪一步的产物可以循环使用?
参考答案:(1)①锗最外层有4个电子,所以其最高价为+4,锗的最高价氧化物为GeO2,与HCl(aq)发生复分解反应,生成的氯化物应为GeCl4和H2O,反应方程式为:GeO2+4HCl═GeCl4+2H2O.
故答案为:GeO2+4HCl═GeCl4+2H2O.
②GeCl4水解反应:GeCl4+4H2O

Ge(OH)4+4HCl(正反应吸热),生成原锗酸H4GeO4与HCl,原锗酸H4GeO4失水变为锗酸H2GeO3,反应方程式为GeCl4+4H2O═H4GeO4+4HCl、H4GeO4═H2GeO3+H2O(或GeCl4+3H2O═H2GeO3+4HCl?)
故答案为:GeCl4+4H2O═H4GeO4+4HCl、H4GeO4═H2GeO3+H2O(或GeCl4+3H2O═H2GeO3+4HCl?).
③GeCl4水解反应:GeCl4+4H2O

Ge(OH)4+4HCl(正反应吸热),生成原锗酸H4GeO4与HCl,加热平衡向右移动,HCl逸出,且水分不断蒸发,原锗酸H4GeO4失水变为锗酸H2GeO3,H4GeO4失水变为锗酸H2GeO3,锗酸受热分解为GeO2.
锗酸受热分解为GeO2与水,反应方程式为H2GeO3??△?.?GeO2+H2O.
故答案为:H2GeO3??△?.?GeO2+H2O.
④GeO2与H2发生氧化还原反应,H2夺去GeO2中的O生成H2O,Ge被还原出来.反应方程式为GeO2+2H2?△?.?Ge+2H2O.
故答案为:GeO2+2H2?△?.?Ge+2H2O.
(2)前三步的主要作用是分离、提纯和富集锗的氧化物.
第②步中产生的盐酸可以循环到第①步中使用,①③④中产生的水也可以循环到第②步使用.
故答案为:前三步的主要作用是分离、提纯和富集锗的氧化物.
第②步中产生的盐酸可以循环到第①步中使用,①③④中产生的水也可以循环到第②步使用.
本题解析:
本题难度:一般
|