微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某元素的微粒37X-的核外电子数为18,则该元素原子的中子数是 (?)
A.17
B.18
C.19
D.20
参考答案:D
本题解析:略
本题难度:简单
2、填空题 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原予序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如图。

请回答:
(1)A元素的名称是________________________;
(2)B元素原子核外运动状态不同的电子数为__________,C元素原子价电子层的电子排布图为_____________,B与A形成的化合物比C与A形成的化合物沸点高,其原因是_____________;
(3)元素E在周期表中的位置是______,它的+2价离子的电子排布式为____________;
(4)由以上五种元素的任意两种形成常见化合物中,所含离子键成分最多的可能为__________(填写化学式);
(5)如图所示,D跟B形成的离子化合物晶体的密度为ag·cm-3,则晶胞的体积是_______________(只要求列出算式)。
参考答案:(1)氢? (1分)
(2)9 (2分)? ?(2分)?
?(2分)?
HF分子间存在氢键,HCl分子间没有氢键(2分)
(3)第四周期第ⅦB族(2分)? 1s22s22p63s23p63d5或[Ar]3d5 (2分)
(4)CaF2? (2分)?(5)V = 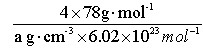 ?(2分)
?(2分)
本题解析:在前36号的元素中,符号周期表中1—18列中的第7列元素的是25号元素锰元素,即E是Mn。则D是Ca。由晶胞的结构可计算出还有的B和D的离子数,含有的D是8×1/8+6×1/2=4,B离子全部在晶胞内,故含有的B是8。所以化学式为DB2,Ca是+2价的,因此B是-1价的,则B可能是F或Cl。B和C属同一主族,原子序数小于C的,且均属于前36号元素,因此B只能是F,C则是Cl。A与其他4种元素既不在同一周期又不在同一主族,所以A是第一周期的氢原子。
(1)氢
(2)F元素元素原子核外有9的电子,因此就有9个运动状态不同的电子。Cl元素的价电子就是最外层电子,电子排布图为
B与A形成的化合物和C与A形成的化合物分别是HF和HCl,由于前者分子间含有氢键,而后者没有,所以其化合物的沸点高。
(3)根据构造原理可写出其+2价离子的电子排布式,即1s22s22p63s23p63d5或[Ar]3d5。
(4)金属性和非金属性越强,所形成的离子键成分越多,所以化学式为CaF2。
(5)因为1个晶胞中含有的Ca2+和F-分别是4和8,因此含有的CaF2的物质的量是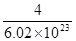 ,CaF2的摩尔质量是78g·mol-1,所以晶胞的体积是
,CaF2的摩尔质量是78g·mol-1,所以晶胞的体积是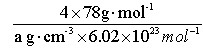
本题难度:一般
3、填空题 用元素符号填空:
(1)第四周期中,原子的4p轨道半充满的元素是______________,3d轨道半充满的元素是______________。
(2)第三周期中有两个成单电子的元素是______________。
参考答案:(1)As? Cr、Mn? (2)Si? S
本题解析:(1)4p轨道半充满,则4s全充满,因此外围电子排布式为4s24p3,所以为As;3d轨道半充满,外围电子排布式为3d54s1或3d54s2,所以为Cr、Mn。(2)第三周期中,有两个成单电子,外围电子排布为3s23p2或3s23p4,所以为Si、S。
本题难度:简单
4、选择题 应用元素周期律的有关知识,可以预测我们不知道的一些元素及其化合物的性质。下列预测中不正确的是
①Be的氧化物的水化物可能具有两性
②Tl能与盐酸和NaOH溶液作用,均产生氢气
③At单质为有色固体,At难溶于水易溶于四氯化碳
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体
⑥H2Se是无色、有毒,比H2S稳定的气体
A.①②③④
B.②④⑥
C.①③⑤
D.②④⑤
参考答案:B
本题解析:在周期表中Be和Al处于对角线关系,氧化铝是两性氧化物,则Be的氧化物的水化物可能具有两性,①正确;Tl和Al处于同一主族,同主族自上而下金属性逐渐增强,因此Tl能与盐酸反应产生氢气,但不能和NaOH溶液作用产生氢气,②不正确;卤素单质均是有色物质,难溶于水易溶于有机溶剂中。At也是卤素,因此At单质为有色固体,At难溶于水易溶于四氯化碳,③正确;Li在氧气中剧烈燃烧,产物是LiO2,Li没有过氧化物,④不正确;第ⅡA族元素的硫酸盐均是难溶性物质,Sr是第ⅡA族元素,所以SrSO4是难溶于水的白色固体,⑤正确;同主族阻塞性非金属性逐渐减弱,氢化物的无锡逐渐减弱,所以H2S比H2Se稳定,⑥不正确,答案选B。
本题难度:一般
5、填空题 (10分)A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两种元素的原子核外电子数之和等于B原子的质子数,B2-的结构示意图为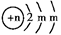 ,请回答下列问题:
,请回答下列问题:

(1)写出A、B、两种元素的符号:A ?,B?。?
(2)B位于周期表中第?周期第?族。
(3)C的氢化物的电子式为??;
(4)BC6作致冷剂替代氟利昂,对臭氧层完全没有破坏作用,是一种很有发展潜力的致冷剂,且BC6在温度高于45度以上时为气态,BC6属于??(填“离子”、“共价”)化合物。
参考答案:(1)N? S?(2)ⅥA?(3)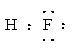 (4) 共价
(4) 共价
本题解析:(1)根据B离子的结构示意图可知,m=8,所以B是S。所以根据元素在周期表中的位置可知,A是N,C是F。
(3)S位于周期表的第三周期第ⅥA族。
(3)氟化氢是含有极性键的共价化合物,电子式为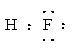 。
。
(4)BC6在温度高于45度以上时为气态,这说明该化合物析出的晶体是分子晶体,所以BC6属于共价化合物。
本题难度:一般