微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室欲制氢气,所用稀盐酸和稀硫酸的浓度相同,反应速率最快的是
[? ]
A.纯锌与稀硫酸反应
B.纯锌和浓硫酸反应
C.纯锌与稀盐酸反应
D.粗锌(含铅、铜杂质)与稀硫酸反应
参考答案:D
本题解析:
本题难度:简单
2、选择题 某同学设计的铜锌原电池如右图所示,则下列说法正确的是
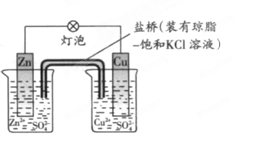
A.因为锌与硫酸锌,铜与硫酸铜不反应,所以该装置无法工作
B.电池反应为:Zn2++Cu=Zn +Cu2+
C.盐桥中的Cl-移向ZnSO4溶液
D.在外电路中,电流从负极流向正极
参考答案:C
本题解析:A、构成原电池的条件是活泼性不同的金属,或金属与非金属,导线相连并插入到电解质溶液中。锌的金属性强于铜。因此根据装置可知,该装置是原电池,可以工作,A不正确;B、锌是负极,铜是正极,溶液中的铜离子得到电子,所以电池反应为Zn+Cu2+=Zn2++Cu,B不正确;C、原电池中负极失去电子,电子沿导线传递到正极。因此溶液中的阳离子向正极移动,则阴离子向负极移动,所以盐桥中的Cl-移向ZnSO4溶液,C正确;D、在外电路中,电流从正极流向负极,D不正确,答案选C。
本题难度:一般
3、选择题 摩托罗拉公司研发了一种由甲醇、氧气以及强碱作电解质溶液的新型手机电池,容量达氢镍电池或锂电池的十倍,可连续使用一个月才充电一次。其电池反应为:2CH3OH+3O2+4OH- 2CO32-+6H2O,则下列说法不正确的是 ( )
2CO32-+6H2O,则下列说法不正确的是 ( )
A.充电时,电能转化为化学能
B.充电时,电解质溶液的pH逐渐增大
C.放电时,CH3OH参与反应的电极为负极,发生还原反应
D.放电时,负极的电极反应为:CH3OH+8OH--6e-===CO32-+6H2O
参考答案:C
本题解析:充电相当于电解池,电能转化为化学能,A正确;根据总的反应式可知,充电时生成OH—,pH逐渐增大,B正确;放电相当于原电池,甲醇在负极失去电子,发生氧化反应。由于电解质是强碱,所以负极电极反应式是CH3OH+8OH--6e-===CO32-+6H2O,C不正确,D正确,答案选C。
点评:该类试题的关键是理解充电相当于是电解池,而放电相当于是原电池,然后再依据相应的判断标准逐一分析即可。至于燃料电池中电极反应式的书写,还必须考虑到电解质溶液的酸碱性,而不能死记硬背,生搬硬套,需要灵活运用知识。
本题难度:一般
4、填空题 如图所示装置:
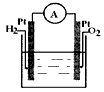
(1)若烧杯中溶液为稀硫酸,两极反应式为:正极? ?; 负极? 。
(2)若烧杯中为氢氧化钠溶液,两极反应式为:正极? ?; 负极? ? 。
(3)若烧杯中为氯化钠溶液,两极反应式为:正极? ; 负极? ?。
参考答案:(1)正极:O2+4e-+4H+==2H2O; 负极:2H2-4e-==4H+。
(2)正极:O2+4e-+2H2O==4OH-; 负极:2H2-4e-+4OH-==4H2O。
(3)正极:O2+4e-+2H2O==4OH-; 负极:2H2-4e-==4H+。
本题解析:
本题难度:一般
5、填空题 化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):
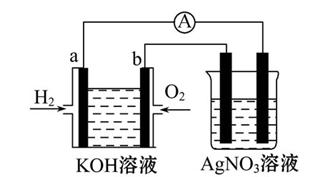
(1)对于氢氧燃料电池,下列表达不正确的是 。
A.a电极是负极,OH-移向负极
B.b电极的电极反应为:O2+2H2O+4e-=4OH-
C.电池总反应式为:2H2+O2 2H2O
2H2O
D.电解质溶液的pH保持不变