微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)配平下列离子反应方程式:______Cu2S+______HNO3--______Cu(NO3)2+______H2SO4+______NO+______H2O
(2)在标准状况下生成2.24LNO时,转移电子物质的量为______.
参考答案:(1)Cu化合价从+1变为+2,S化合价从-2变为+6;N化合价从+5变为+2
则化合价升高=1×2+8=10
化合价降低=5-2=3
化合价升降最小公倍数为30,所以Cu2S的系数为3,NO系数为10,再根据原子守恒观察配平其它物质的系数,所以
3Cu2S+22HNO3═6Cu(NO3)2+3H2SO4+10NO+8H2O
故答案为:3;22;6;3;10;8
(2)转移电子物质的量2.24L22.4L/mol×3=0.3mol.
故答案为:0.3mol
本题解析:
本题难度:一般
2、选择题 取5.06g由等物质的量的NaBr和NaI组成的混合物样品溶于水,然后通入224mL(标准状况下)Cl2 充分反应,则被氧化的Br-的物质的量是
A.0
B.0.01mol
C.0.02mol
D.0.04mol
参考答案:A
本题解析:略
本题难度:简单
3、选择题 某氮的氧化物和CO在催化剂存在下充分反应,生成物质的量之比为1︰2的N2和CO2,该氧化物是(?)
A.N2O
B.NO
C.NO2
D.N2O5
参考答案:B
本题解析:氮气是还原产物,CO2是氧化产物。根据得失的得失守恒可知,生成1mol氮气,转移4mol电子,所以平均1个氮原子得到2个电子,因此氧化物中氮元素的化合价是+2价,选项B正确,答案选B。
本题难度:一般
4、选择题 将6.85g Fe和Al的混合物溶于200mL 浓度为C mol/L的HNO3溶液中,得到标准状况下的NO、N2O混合气体共3.36L,测得反应后溶液的pH为0,再向所得溶液中加入过量NaOH溶液充分反应后生成沉淀质量为5.35 g。若不考虑反应前后溶液体积变化,则下列有关判断正确的是(?)。?
A.Fe与Al 的物质的量之比为1:1
B.混合气体中NO为0.03mol ,N2O为0.12mol
C.原HNO3溶液的浓度C=4.9mol/L
D.反应中被还原的HNO3为0.15mol
参考答案:C
本题解析:向反应后的溶液中加入过量NaOH生成Fe(OH)3沉淀5.35g,则n(Fe)=0.05mol;由金属的总质量计算得n(Al)=0.15mol,两者的物质的量之比为1:2;由得失电子守恒,失电子总量为0.05×3+0.15×3=0.6mol,假设NO的物质的量为x,N2O的物质的量为y,得电子总量为(5-2)×x+2(5-1)×y=0.6,由混合气体在标况的体积3.36L,列式(x+y)=3.36L/22.4L/mol,得x=0.12mol,y=0.03mol;原溶液中硝酸的物质的量为表现酸性的部分+表现氧化性的部分+剩余的部分:n(HNO3)=0.05×3+0.15×3+0.12+0.03×2+1×0.2=0.98, C=4.9mol/L;其中被还原的部分为0.08mol。
本题难度:一般
5、填空题 (本题16分)无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业制备无水AlCl3的流程如下:
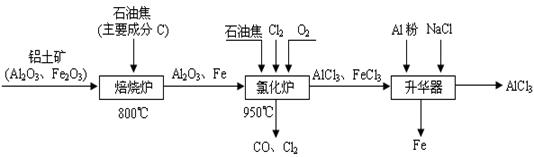
(1)氯化炉中通入O2的目的是? _________。
(2)氯化炉中Al2O3、C12和C反应的化学方程式是____________________________。
(3)氯化炉中导出的气体,通常用亚硫酸钠溶液来吸收,请写出用Na2SO3溶液处理尾气时发生反应的离子方程式___________________________________________________。
(4)在升华器中加入铝粉的目的是_________________________________________。
(5)用氯化铝晶体(AlCl3·6H2O)在HCl气中加热也能进行无水氯化铝的制备。但若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原氯化铝晶体(AlCl3·6H2O)的40%,则可推算n的值为?。
(6)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为___________________________________。
参考答案:
(1)与C反应,提供反应所需的热量 (2分)
(2)Al2O3+3Cl2+3C = 2AlCl3+3CO (800 ℃)(3分)
(3)SO32-+Cl2+H2O=SO42-+2H++2Cl-?(3分)?
(4)将FeCl3杂质还原成Fe除去 (2分)
(5)4 (3分)
(6)Al-3e-+4Cl-= AlCl4-(3分)
本题解析:工艺流程题要弄清原料及成分、所要制备的产品,给出的已知条件也是常设问题的地方要十分注意。
(1)通入氧气的目的,通氧气后出来的产物就可以知道是和碳反应,除此以外就是反应放热为其它反应提供能量。
(2)根据箭头的指向,C被还原成CO,氯气被还原成AlCl3,所以C+Al2O3+Cl2→CO+AlCl3
然后再利用氧化还原反应的配平方法进行配平。
(3)利用的是亚硫酸钠的还原性,氯气的氧化性,在溶液中亚硫酸根被氧化后生成硫酸根离子,氯气单质被还原后则是氯离子,写方程式时可以先写SO2+ Cl2→2Cl—+SO42—再根据电原子守恒和电荷守恒,在边补上水,右边补上氢离子,配平就可以了。
(4)由“升华器”处可知,要将铁元素除去,结合题意可知将FeCl3杂质还原成Fe除去。
(5)由2(AlCl3·6H2O)转化成Al2(OH)nCl(6-n)可知,
2×(27+35.5×3+6×18)×40%=27×2+17n+35.5×(6-n),求得n=4
(6)先写Al-3e- →AlCl4-,根椐原子守恒和电荷守恒补齐就行。
本题难度:一般