微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 高锰酸钾(KMnO4)是一种常用的氧化剂。
(1)有下列变化:CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,找出其中一个变化与“MnO4-→Mn2+”组成一个反应,写出该反应的离子方程式:?。
(2)高锰酸钾可代替二氧化锰用来制取Cl2,则反应中氧化剂和还原剂的物质的量之比为?。
(3)高锰酸钾与硫化亚铁有如下反应:10FeS+6KMnO4+24H2SO4=3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O。若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生转移的电子数目为?。
参考答案:(1)2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
(2)1∶5 (3)0.15NA(或9.03×1022)
本题解析:(1)MnO4-→Mn2+为还原过程,故与之对应的应为氧化过程C2O42-→CO2。根据得失电子守恒将方程式配平即可。(2)酸性条件下,KMnO4溶液的氧化性较强,其与浓盐酸反应时,被还原为Mn2+,根据电子守恒可知氧化剂和还原剂(HCl)物质的量之比为1∶5。(3)根据方程式可得关系式:
10FeS ~ 10S ~ Δm ~ e-
880 g? 320 g? 560 g? 30 mol
2.8 g? n(e-)
n(e-)=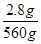 ×30 mol=0.15 mol。
×30 mol=0.15 mol。
本题难度:一般
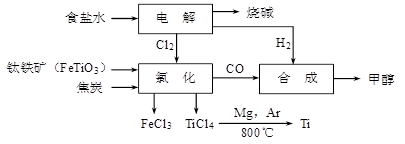
2、选择题 钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
请回答下列问题:
(1)Fe的原子序数为26,其最外层电子数为2,请写出铁原子结构示意图_______。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式?。
(3)氯碱厂获得Cl2的离子方程式为??
?
| TiCl4
| Mg
| MgCl2
| Ti
|
熔点/℃
| -25.0
| 648.8
| 714
| 1667
|
沸点/℃
| 136.4
| 1090
| 1412
| 3287
|
?
(4)由TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于?℃即可。
(5)为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为 ??时,理论上Cl2的利用率最大。
参考答案:(1)
(2)2FeTiO3+6C+7Cl2高温2FeCl3+2TiCl4+6CO (2分)
(3)2Cl- + 2H2O  ?H2↑ + Cl2↑ + 2OH-(2分)
?H2↑ + Cl2↑ + 2OH-(2分)
(4)1412?(2分)
(5)7:1
本题解析:(1)铁位于元素周期表的第4周期第Ⅷ族,是过渡金属元素的代表,原子序数为26,电子层结构为:
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为FeTiO3+6C+7Cl2高温2FeCl3+2TiCl4+6CO;
(3)工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。阳极反应:2Cl--2e-=Cl2↑(氧化反应);阴极反应:2H++2e-=H2↑(还原反应);因此,电解饱和食盐水的总反应可以表示为:2Cl- + 2H2O  ?H2↑ + Cl2↑ + 2OH-;
?H2↑ + Cl2↑ + 2OH-;
(4)Ar气中进行防止钛、镁被氧化;控制温度使TiCl4、Mg、MgCl2转化为蒸气,Ti不熔化,故温度略高于1412℃;
(5)根据2Cl- + 2H2O  ?H2↑ + Cl2↑ + 2OH-;再根据图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+
?H2↑ + Cl2↑ + 2OH-;再根据图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+ 2FeCl3+2TiCl4+6CO,得出关系式2FeTiO3?~? 7Cl2?~ 14NaCl,所以为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为7:1时,理论上Cl2的利用率最大。
2FeCl3+2TiCl4+6CO,得出关系式2FeTiO3?~? 7Cl2?~ 14NaCl,所以为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为7:1时,理论上Cl2的利用率最大。
本题难度:一般
3、选择题 在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+ F2 + 2OH-══ RO4-+ 2F-+ H2O 。从而可知在
RO3n-中,元素R的化合价是
[? ]
A.+4
B.+5
C.+6
D.+7
参考答案:B
本题解析:
本题难度:简单
4、填空题 (6分)金属铜的提炼多从黄铜矿开始。黄铜矿的焙烧过程中主要反应之一的化学方程式为:2CuFeS2+O2= +2FeS+SO2,(方程式已配平)
+2FeS+SO2,(方程式已配平)
(1)方框中的物质应为_________?
(2)若有1 molSO2 生成,则反应中电子转移数目为____? _____
(3)SO2是?产物。
参考答案:(6分) (1).Cu2S (2). 6NA? (3).氧化
本题解析:(1)根据原子守恒可知,该物质是由2个铜原子和1个S原子形成的,所以是Cu2S。
(2)根据方程式可知,每消耗2molCuFeS2,其中被氧化的S元素是1mol,所以失去电子的物质的量是[4-(-2)]mol=6mol,因此转移电子的数目是6NA。
(3)SO2是还原剂中的S元素氧化而产生的,所以是氧化产物。
本题难度:一般
5、填空题 (16分)四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2 、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的
、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的 主要步骤如下:
主要步骤如下:
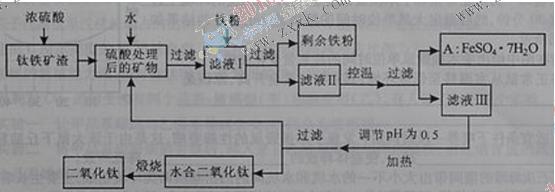
请回答下列问题:
(1)?硫酸与二氧化钛反应的化学方程式是____________________________________。
(2)?向滤液I中加入铁粉,发生反应的离子方程式为:_________________________、_______________________________________。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_______________________________________________。
过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、___________、______________、_______________________(填化学式),减少废物排放。
(4)A可用于生产红色颜料(Fe2O3),其方法是:将556a kg A(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐 色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
参考答案:
(1) 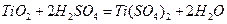 或
或
(2)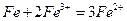 ?
?
(3) 加水促进钛盐水解,加热促进钛盐水解,降低 浓度促进钛盐水解
浓度促进钛盐水解
 ?
? ?
?
(4) 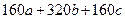
本题解析:略
本题难度:简单