微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 物质在水溶液中有不同的行为。按要求回答下列问题:
(1)Na2SO3溶液显碱性,其原因是______________________________(用离子方程式表示),该溶液中各离子浓度由大到小的顺序为______________________。
(2)室温下向10mL氨水溶液中加水稀释后,下列量增大的有__________(填编号,下同),减小的有___________,不变的有____________。
a.溶液中离子浓度?b.氨水的电离程度
c.水的离子积常数? d.c(H+)/ c(NH3·H2O)
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量?(填“相同”或“不相同”),其原因是?。
参考答案:(1)SO32-+H2O HSO3-+OH-(2分);(写一步即可得分)
HSO3-+OH-(2分);(写一步即可得分)
c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);(2分)
(2) b,d(2分);a;(1分)c(1分)
(3)相同(1分) Fe2+与变质前后的NaClO2反应,最后的还原产物都是NaCl,根据电子守恒消耗的Fe2+物质的量应相同(2分)
本题解析:(1)Na2SO3为弱酸强碱盐,SO32?水解显碱性,离子方程式为:SO32-+H2O HSO3-+OH-;因为SO32?水解,使溶液显碱性,所以离子浓度由大到小的顺序为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。
HSO3-+OH-;因为SO32?水解,使溶液显碱性,所以离子浓度由大到小的顺序为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。
(2)室温下向10mL氨水溶液中加水稀释后,氨水浓度减小,a、溶液中离子浓度减小;但水解平衡向右移动,所以b、氨水的电离程度增大;c、水的离子积常数受温度影响,不变;d、因为c(H+)/增大,c(NH3·H2O)减小,所以c(H+)/ c(NH3·H2O)增大。
(3)NaClO2做氧化剂转化为Cl?,3molNaClO2得12mol e?,3mol NaClO2变质可分解为2mol NaClO3和1mol NaCl,2mol NaClO3做氧化剂转化为Cl?,得12mol e?,所以取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相等。
本题难度:一般
2、选择题
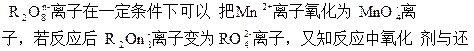
原剂的物质的量之比为5∶2。则n的值是?
A.1
B.2
C.3
D.4
参考答案:B
本题解析: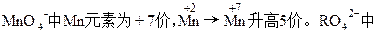
R元素为+6价。设R2O8n-中R元素的化合价为+x价关系式:5R2O8n-~2Mn2+
5×2×(x-6)=5×2
x=7
R2O8n-中,2×7+(-2)×8=-n
n=2
本题难度:一般
3、选择题 FeS与一定浓度HNO3反应,生成Fe2(SO4)3.Fe(NO3)3.NO2.NO和H2O,当NO2和NO的体积为1∶1时实际参加反应的FeS与HNO3的物质的量之比是(?)
A.4∶9
B.2∶9
C.2∶11
D.1∶7
参考答案:C
本题解析:略
本题难度:一般
4、选择题 新型净水剂—高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O、②Na2FeO4+2KOH=K2FeO4+2NaOH。下列说法不正确的是
A.反应①为氧化还原反应,反应②为复分解反应
B.反应①中氧化产物与还原产物物质的量之比为2:9
C.反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒
D.若有2mol FeCl3发生反应,转移电子的物质的量为6 mol
参考答案:B
本题解析:A、根据方程式2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O可知,铁元素的化合价从+3价升高到+6价,失去3个电子,被氧化,因此氯化铁是还原剂。氯元素的化合价从+1价降低到-1价,得到2个电子,被还原,所以次氯酸钠是氧化剂,即反应①是氧化还原反应。而反应②是离子间相互交换成分,生成另外一种盐和另外一种碱,因此是复分解反应,A正确;B、反应①中氧化产物是高铁酸钠,还原产物是氯化钠。由于还原剂与氧化剂的物质的量之比是2:3,因此反应中氧化产物与还原产物物质的量之比为2:3,B不正确;C、反应②的产物K2FeO4中Fe为+6价,价态高,易得到电子,具有强氧化性,能杀菌消毒,C正确;D、铁元素的化合价从+3价升高到+6价,失去3个电子,因此若有2mol FeCl3发生反应,转移电子的物质的量为6 mol,D正确,答案选B。
本题难度:一般
5、填空题 化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
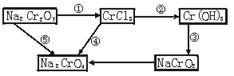
(1)在上述有编号的步骤中,需用还原剂的是___________,需用氧化剂的是___________ (填编号)。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是___________(填化学式)。
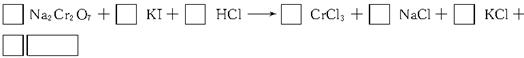
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
参考答案:(1)①?④
(2)Cr(OH)3
(3)1? 6? 14? 2? 2? 6? 3 ?7? H2O
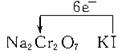
本题解析:(1)在①变化中,Cr元素由+7价变为+3价,化合价降低,需还原剂;②③两步变化中Cr元素的价态都是+3价,⑤步变化中Cr元素的价态都是+7价,②③⑤都是非氧化还原反应;在④步变化中,Cr元素由+3价变为+7价,化合价升高,需要氧化剂。
(2)Cr(OH)3既能与盐酸反应生成CrCl3,又能与NaOH反应生成NaCrO2,为两性氢氧化物。
(3)此小题考查了化学方程式的配平方法。先找出该反应的氧化剂、还原剂及氧化产物、还原产物,并配出其化学计量数;再由原子守恒配出NaCl、KCl的计量数,最后补充H2O,并配平其计量数。
本题难度:简单