微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)工业合成氨技术的反应原理是:N2(g)+3H2(g)
2NH3(g)△H=-92.4kJ/mol.在500℃、20MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量变化如图1所示,回答下列问题:
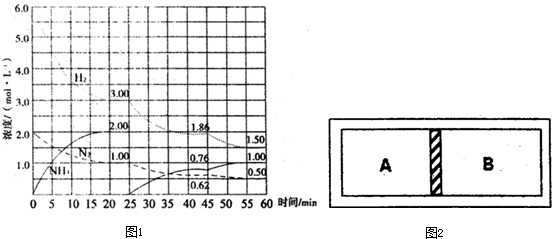
①计算反应在第一次平衡时平衡常数K=______(保留二位小数)
②产物NH3在5~10min、20~25min和45~50min时平均反应速率[平均反应速率分别以v1、v2、v3表示]从大到小排列次序为______.
③在45min时,采取的措施是______;
(2)如图2是一个体积固定的恒温密闭容器,正中间有一个可以滑动的隔板将容器隔成A、B两室.A室放入H2和O2共5mol,B室放入H2和N2共5mol,使隔板恰好处于正中间.
①控制一定条件,只使A室气体充分反应,此时隔板左移,待反应完成且密闭容器温度恒定(大于120℃)后,A室气体体积是B室体积的.计算原H2和O2的体积比为______.
②再控制一定条件,使H2和N2发生反应(正反应放热).当密闭容器温度恒定(大于120℃)且达到平衡时,隔板右移恰好回到正中间,若加入的N2为1mol,则N2的转化率为______,若加入的N2为xmol,则x的取值范围是______.
2、计算题 将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g),经5min后,测得D的浓度为0.5 mol·L-1,C的平均反应速率是0.1 mol·L-1·min-1,且c(A)﹕c(B)=3﹕5。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5 mol·L-1,C的平均反应速率是0.1 mol·L-1·min-1,且c(A)﹕c(B)=3﹕5。求:
⑴、此时A的浓度c(A)=?____ mol·L-1;
⑵、反应开始前放入容器中B物质的量n(B)=?____ mol;
⑶、B的平均反应速率v(B)=?___ mol·L-1·min-1;
⑷、x=?____ 。
3、填空题 工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) CO2(g)+H2(g)?△H=-41?kJ/mol 某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V?L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
CO2(g)+H2(g)?△H=-41?kJ/mol 某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V?L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
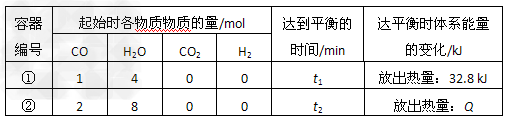
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量__________(填“大于”、 “小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为__________?%。
(3)计算容器②中反应的平衡常数K=?_____________。
(4)下列叙述正确的是____________(填字母序号)。 ?
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q?>?65.6?kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为: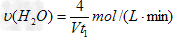
(5)已知:2H2?(g)?+?O2?(g)?==?2H2O?(g)?ΔH=-484?kJ/mol,写出CO完全燃烧生成CO2 的热化学方程式:_______________。
(6)容器①中反应进行到t?min时,测得混合气体中CO2的物质的量为0.6?mol。若用 200?mL?5?mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)_____________。?
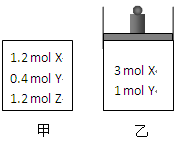
4、选择题 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3 X(g)+Y(g)  ?2 Z(g)?ΔH<0保持温度不变,测得平衡时的有关数据如下:
?2 Z(g)?ΔH<0保持温度不变,测得平衡时的有关数据如下:
?
| 恒容容器甲
| 恒压容器乙
|
X的物质的量(mol)
| n1
| n2
|
Z的体积分数
| φ1
| φ2
|
下列说法正确的是
A.平衡时容器乙的容积一定比反应前小? B.平衡时容器甲的压强一定比反应前小
C.n2>n1? D.φ2>φ1
5、简答题 (12分)硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一。
(1)现将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,反应2SO2(g)+O2(g) 2SO3(g)达到平衡状态。
2SO3(g)达到平衡状态。
①上述反应平衡常数的表达式K=__________
②能判断该反应达到平衡状态的标志是__________。(填字母)
a. SO2和SO3浓度相等? b. SO2百分含量保持不变
c. 容器中气体的压强不变? d. SO3的生成速率与SO2的消耗速率相等。
(2)某温度下,SO2的平衡转化率(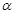 )与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)__________K(B)(填“>”、“<”或“=”)。
)与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)__________K(B)(填“>”、“<”或“=”)。
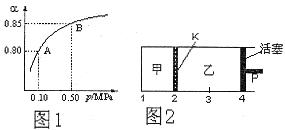
(3)如图2所示,保持温度不变,在一定反应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲__________乙。(填:“大于”、“小于”、或“等于”)
②若在甲容器中通入一定量的He气,使容器内的压强增大,则c(SO3)/c(SO2)将__________填:“增大”、“减小”、“不变”、“无法确定”)
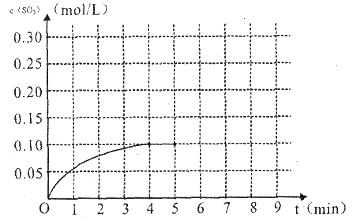
(4)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。