微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+
O2(g)=CO2(g)+2H2(g)△H=-192.9kJ/mol
根据上述反应,下列说法正确的是( )
A.反应①中的能量变化如图所示

B.CH3OH转变成H2的过程一定要吸收能量
C.1?mol?CH3OH充分燃烧放出的热量为192.9?kJ
D.可推知2H2(g)+O2(g)=2H2O(g)△H=-483.8?kJ/mol
参考答案:D
本题解析:
本题难度:简单
2、填空题 已知下列三个热化学方程式
①H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8?kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH=-393.5?kJ·mol-1
③C(s)+H2O(g)===CO(g)+H2(g)?ΔH=+131?kJ·mol-1
写出表示碳燃烧生成CO和CO燃烧生成CO2的燃烧热的热化学方程式。
_________________________________________;
_________________________________________。
参考答案:C(s)+1/2O2(g)===CO(g)?ΔH=-110.8?kJ·mol-1
CO(g)+1/2O2(g)===CO2(g)?ΔH=-282.7?kJ·mol-1
本题解析:
本题难度:一般
3、选择题 下列各组热化学方程式程中,化学反应的△H前者大于后者的是
[? ]
①C(s)+O2(g)=CO2(g);△H1 C(s)+1/2O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4
③H2(g)+1/2O2(g)=H2O(g);△H5 2H2(g)+O2(g)=2H2O(l);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)=Ca(OH)2(s);△H8
A.①
B.④
C.②③④
D.①②③
参考答案:C
本题解析:
本题难度:一般
4、选择题 现有如下三个热化学方程式:
H2(g)+1/2O2(g)===H2O(g) ΔH=a kJ·mol-1
H2(g)+1/2O2(g)===H2O(l) ΔH=b kJ·mol-1
2H2(g)+O2(g)===2H2O(l) ΔH=c kJ·mol-1
下列关于它们的表述正确的是
[? ]
A.它们都是吸热反应
B.a,b和c均为正值
C.a=b
D.2b=c
参考答案:D
本题解析:
本题难度:简单
5、填空题 甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”).
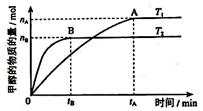
②在其他条件不变得情况下,考察温度对反应II的影响,实验结果如图所示
由图中数据判断 ΔH2 0 (填“>”,“=”或“<”).
③某温度下,将2 mol CO2和6 mol H2充入2L的密闭容器中,发生反应II,达到平衡后,测得c(CO2)= 0.2 mol/L, 则此时容器中的压强为原来的 倍
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为 。
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.

①该电池负极的电极反应为
②此电池消耗甲醇1.6克时,反应中电子转移数目为
③若以此燃料电池为铅蓄电池充电,则应将图中右侧电极连接蓄电池的 (填正极或负极)
参考答案:(1) ① I ② < ③ 0.6 (2)442.8 KJ (3)CH3OH+8OH- -6e- = CO32- +6H2O0.3NA 负极
本题解析:(1)原子经济就是反应物的原子全部转化为生成物。选择反应I的化合反应。由图可知:T2>T1。升高温度甲醇的物质的量减少,说明升高温度化学平衡向逆反应方向移动。根据平衡移动原理:升高温度化学平衡向吸热反应方向移动。即逆反应方向是吸热反应,所以正反应是放热反应。故△H2<0.③反应开始时C(CO2)="1mol/L," C(H2)=3mol/L由于达到平衡后,测得c(CO2)= 0.2 mol/L,CO2改变浓度是0.8mol/L,所以H2改变浓度为2.4mol/L. H2平衡浓度为0.6mol/L.产生的甲醇、水蒸汽的浓度都是0.8mol/L.平衡时总浓度是2.4mol/L,而开始时总浓度是4mol/L。所以这时的压强是开始的2.4mol/L÷4mol/L=0.6倍。(2)①-②+③×4得:2CH3OH(l) + 2O2(g) =" 2CO" (g) + 4H2O(l) ΔH =-1275.6 kJ/molΔH =-885.6 kJ/mol。所以产生1mol一氧化碳和液态水放出的热量为442.8 KJ.(3)甲醇燃料电池的负极是通入甲醇的电极,电极反应为CH3OH+8OH- -6e- = CO32- +6H2O。每摩尔的甲醇反应转移电子9摩尔。消耗甲醇1.6克时,n(CH3OH)=1.6g÷32g/mol=0.05mol,所以转移电子0.3 NA。③若以此燃料电池为铅蓄电池充电,则应将图中右侧电极连接蓄电池的负极。
考点:考查燃料电池、电解池的由于及电极反应、电子转移等知识。
本题难度:困难