微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列热化学方程式书写正确的是( ? )
A.C(s)+O2(g)═CO2(g);△H=+393.5kJ/mol
B.2SO2+O2═2SO3;△H=-196.6kJ/mol
C.H2(g)+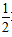 O2(g)═H2O(l);△H=-285.8kJ/mol
O2(g)═H2O(l);△H=-285.8kJ/mol
D.2H2(g)+O2(g)═2H2O(l);△H=-571.6KJ
参考答案:C
本题解析:
本题难度:简单
2、填空题 (1)一定条件下,可逆反应:A2(g)+B2(g)  2C(g)达到平衡时,各物质的
2C(g)达到平衡时,各物质的
平衡浓度分别为:c(A2)=0.5 mol·L-1;c(B2)=0.1 mol·L-1;c(C)=1.6 mol·L-1。
若用a、b、c分别表示A2、B2、C的初始浓度(mol·L-1),则:
①a、b应满足的关系式是 。
②a的取值范围是 &# 160; 。
(2)氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,肼(N2H4)可
作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)="===" N2O4 (1) △H1= -19.5kJ·mol-1
②N2H4(1)+O2(g)="===" N2(g)+2H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4反应的热化学方程式 ;
参考答案:(1)①a=b+0.4 ②0.4<a<1.3
(2) 2N2H4(L)+N2O4(L)====3N2(g)+4H2O(g) △H=-1048.9kJ/mol(3分)
本题解析:(1)一定条件下,可逆反应:A2(g)+B2(g)  2C(g)达到平衡时,各物质的平衡浓度分别为:c(A2)=0.5 mol·L-1;c(B2)=0.1 mol·L-1;c(C)=1.6 mol·L-1,若B2(g)完全反应,则a为0.4,即b为0,若C全部全部转化为A2(g)+B2(g),则a为1.3,b为0.9,所以①a、b应满足的关系式是a=b+0.4,而上述是假设状态,故a的取值范围是0.4<a<1.3;(2)肼和N2O4反应的热化学方程式可以由②N2H4(1)+O2(g)="===" N2(g)+2H2O(g)乘以2,再减去①N2(g)+2O2(g)="===" N2O4得到,故肼和N2O4反应的热化学方程式为 2N2H4(L)+N2O4(L)====3N2(g)+4H2O(g△H=-1048.9kJ/mol,(△H=-534.2×2+19.5=-1048.9kJ/mol)。
2C(g)达到平衡时,各物质的平衡浓度分别为:c(A2)=0.5 mol·L-1;c(B2)=0.1 mol·L-1;c(C)=1.6 mol·L-1,若B2(g)完全反应,则a为0.4,即b为0,若C全部全部转化为A2(g)+B2(g),则a为1.3,b为0.9,所以①a、b应满足的关系式是a=b+0.4,而上述是假设状态,故a的取值范围是0.4<a<1.3;(2)肼和N2O4反应的热化学方程式可以由②N2H4(1)+O2(g)="===" N2(g)+2H2O(g)乘以2,再减去①N2(g)+2O2(g)="===" N2O4得到,故肼和N2O4反应的热化学方程式为 2N2H4(L)+N2O4(L)====3N2(g)+4H2O(g△H=-1048.9kJ/mol,(△H=-534.2×2+19.5=-1048.9kJ/mol)。
考点:化学平衡的计算、热化学方程式的书写
点评:本题考查了化学平衡的计算、热化学方程式的书写,该考点是高考考查的热点,本题有利于培养学生对化学平衡计算的理解能力,该难度中等。
本题难度:一般
3、填空题 将化学知识系统化,有助于对化学问题的进一步认识和理解。
资料1:化学反应的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
资料2:化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。
资料3:化学反应的能量变化(ΔH)与反应物和生成物的键能有关。在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(ΔH)。
根据以上资料回答下列问题:
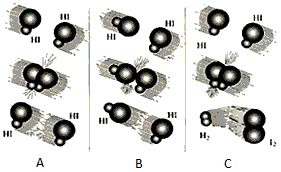
(1)上图是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是 __________________(选填“A”、“B”或“C”);
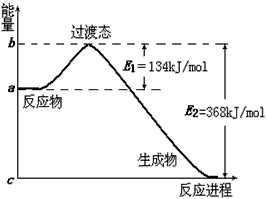
(2)下图是1molNO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ___________________________________________;
(3) 下表是部分化学键的键能数据
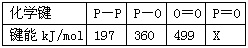
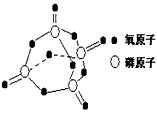
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构(P4O10)如上(右)图所示,则上表中X=
_______________________________。
(4)下图为氧族元素的氢化物a、b、c、d的生成热数据示意图。
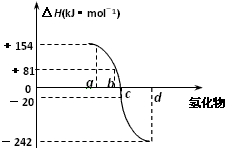
请你归纳:非金属元素的氢化物的稳定性与氢化物的生成热(ΔH)之间的关系:_____________________________________。
参考答案:(1)C
(2)NO2(g)+CO(g)==CO2(g)+NO(g) △H=-234kJ/mol
(3)434(或433.75)
(4)非金属元素的氢化物越稳定,△H越小,反之亦然
本题解析:
本题难度:一般
4、选择题 2008年北京奥运会“祥云”火炬采用的是环保型燃料--丙烷(C3H8),已知丙烷的燃烧热为2221.5kJ?mol-1,下列热化学方程式正确的是( )
A.C3H8(g)+5O2(g)═3CO2(g)+4H2O(g);△H=-2221.5kJ?mol-1
B.2C3H8(g)+10O2(g)═6CO2(g)+8H2O(l);△H=-2221.5kJ?mol-1
C.C3H8(g)+5O2(g)═3CO2(g)+4H2O(g);△H=+2221.5kJ?mol-1
D.C3H8(g)+5O2(g)═3CO2(g)+4H2O(l);△H=-2221.5kJ?mol-1
参考答案:由丙烷的燃烧热为2221.5kJ?mol-1,则1molC3H8完全燃烧生成二氧化碳和水,放出热量为2221.5kJ,
标明各物质的状态,△H<0,
则热化学方程式为C3H8(g)+5O2(g)═3CO2(g)+4H2O(l);△H=-2221.5kJ?mol-1,
故选D.
本题解析:
本题难度:简单
5、填空题 “温室效应”是哥本哈根气候变化大会研究的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有 (填字母)。
a.采用节能技术,减少化石燃料的用量 b.鼓励乘坐公交车出行,倡导低碳生活
c.利用太阳能、风能等新型能源替代化石燃料
(2)一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g) △Hl="+1411.0" kJ/mol
2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g) △H2="+1366.8" kJ/mol
则由乙烯水化制乙醇的热化学方程式是 。
(3)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。

根据上表中数据分析:
①温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率 (填“增大”“减小”或“不变”)。
②该反应的正反应为 (填“吸”或“放”)热反应。
参考答案:(1)abc(2分)(2)C2H4(g)+H2O(l)=C2H5OH(l) △H="-44.2" kJ/mol(2分)
(3)①增大(2分)②放(2分)
本题解析:(1)a.采用节能技术能减少化石燃料的使用,减少化石燃料的使用就减少了二氧化碳的排放,正确;b.化石燃料燃烧产物是二氧化碳,减少化石燃料的使用就减少了二氧化碳的排放,正确;c.利用太阳能、风能能减少化石燃料的使用,化石燃料燃烧产物是二氧化碳,减少化石燃料的使用就减少了二氧化碳的排放,正确;故选abc。
(2)2CO2(g)+2H2O(l)
本题难度:困难