微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
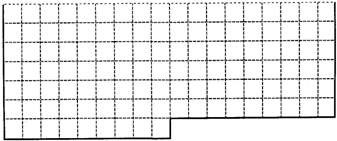
1、填空题 Ⅰ.上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界,并画出金属和非金属的分界线,用阴影画出铁元素所在的族.
Ⅱ.A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期.C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙.A原子的最外层电子数比次外层电子层多3个.E是地壳中含量最高的金属元素.根据以上信息回答下列问题:
(1)D元素在周期表中的位置是______,画出B元素简单离子结构示意图______,乙物质的电子式是______
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是(用元素符号填写)______
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是______
(4)简述比较D与E金属性强弱的实验方法:______
(5)E的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用)其反应方程式为______.
2、选择题 下列叙述正确的是( )
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.晶体中有阴离子则必然有阳离子,有阳离子一定有阴离子
C.A、B为同族上下相邻元素,已知A所在周期有m种元素,B所在周期有n种元素,A的原子序数为x.则B的原子序数为x+m
D.乙醇的沸点比乙醛高,主要是因为乙醇分子间存在氢键,乙醛分子间不能形成氢键
3、选择题 同主族元素形成的同一类型化合物,往往其结构和性质相似.PH4I是一种白色晶体,下列对PH4I的叙述中,正确的是( )
A.它是一种共价化合物
B.它既含离子键又含共价键
C.它不可能与NaOH溶液反应
D.它受热时,不能分解产生有色气体
4、填空题 (1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
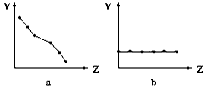

①ⅡA族元素的价电子数____________。
②第三周期元素的最高化合价__________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物对应的水化物的化学式为________ 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,A溶液中水的电离程度比B溶液中水的电离程度小。则化合物A中的化学键类型为________ ,B的化学式为________。
③工业上制取单质M的化学方程式为_____________________________________。
5、选择题 在元素周期表中非金属元素最多的区是
A.s区
B.p区
C.d区
D.ds区