微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
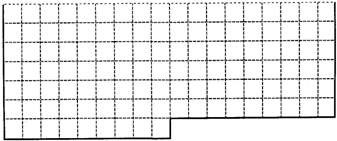
1、填空题 Ⅰ.上表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界,并画出金属和非金属的分界线,用阴影画出铁元素所在的族.
Ⅱ.A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期.C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙.A原子的最外层电子数比次外层电子层多3个.E是地壳中含量最高的金属元素.根据以上信息回答下列问题:
(1)D元素在周期表中的位置是______,画出B元素简单离子结构示意图______,乙物质的电子式是______
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是(用元素符号填写)______
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是______
(4)简述比较D与E金属性强弱的实验方法:______
(5)E的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用)其反应方程式为______.
参考答案:Ⅰ.周期表由短周期和长周期组成,第七周期为不完全周期,在金属与非金属的交界处的元素具有金属性和非金属性,Fe在第ⅤⅢ族,则边界、金属元素与非金属元素的交界、铁所在的族如图,
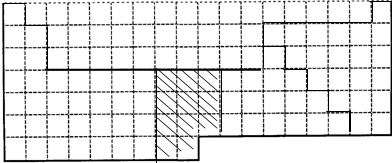
,故答案为:

;
Ⅱ.A、B、C、D、E都是短周期元素,原子序数依次增大,E是地壳中含量最高的金属元素,则E为Al;C、D、E同处另一周期.C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则C为Na,B为O,则D为Mg;A、B处于同一周期,A原子的最外层电子数比次外层电子层多3个,则A为N,
(1)Mg在元素周期表中第三周期IIA族,氧离子的最外层电子数为8,则离子结构示意图为
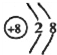
,乙为Na2O2,其电子式为
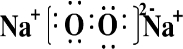
,
故答案为:第三周期IIA族;
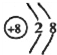
;
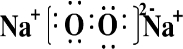
;
(2)电子层越多,原子半径越大,同周期元素的原子半径从左向右减小,则原子半径为O<N<Al<Mg<Na,故答案为:O<N<Al<Mg<Na;
(3)Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)Mg、Al都在第三周期,Mg的金属性强,可利用镁与热水可以反应生成氢氧化镁和氢气,但铝和热水不反应来说明,
故答案为:镁与热水可以反应生成氢氧化镁和氢气,但铝和热水不反应;
(5)E的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,则Al、C、TiO2在高温下反应Al2O3和TiC,
该反应为4Al+3C+3TiO2?高温?.?2Al2O3+3TiC,故答案为:4Al+3C+3TiO2?高温?.?2Al2O3+3TiC.
本题解析:
本题难度:简单
2、选择题 下列叙述正确的是( )
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.晶体中有阴离子则必然有阳离子,有阳离子一定有阴离子
C.A、B为同族上下相邻元素,已知A所在周期有m种元素,B所在周期有n种元素,A的原子序数为x.则B的原子序数为x+m
D.乙醇的沸点比乙醛高,主要是因为乙醇分子间存在氢键,乙醛分子间不能形成氢键
参考答案:D
本题解析:
本题难度:一般
3、选择题 ;同主族元素形成的同一类型化合物,往往其结构和性质相似.PH4I是一种白色晶体,下列对PH4I的叙述中,正确的是( )
A.它是一种共价化合物
B.它既含离子键又含共价键
C.它不可能与NaOH溶液反应
D.它受热时,不能分解产生有色气体
参考答案:A、因NH4Cl是离子化合物,所以PH4I也是离子化合物,故A错误;
B、因NH4Cl中既含离子键又含共价键,所以PH4I中也既含离子键又含共价键,故B正确;
C、因NH4Cl能与NaOH溶液反应,所以PH4I也能与NaOH溶液反应,故C错误;
D、因NH4Cl能分NH4Cl?加热?.?NH3+HCl,所以PH4I?加热?.?PH3+HI,但HI不稳定,还可以继续分2HI(g)?H2(g)+I2(g),I2(g)为紫色,故D错误;
故选:B.
本题解析:
本题难度:一般
4、填空题 (1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
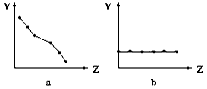

①ⅡA族元素的价电子数____________。
②第三周期元素的最高化合价__________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物对应的水化物的化学式为________ 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,A溶液中水的电离程度比B溶液中水的电离程度小。则化合物A中的化学键类型为________ ,B的化学式为________。
③工业上制取单质M的化学方程式为_____________________________________。
参考答案:(1)①b;②c;③a
(2)①HClO4;②离子键、(极性)共价键;NaClO;③SiO2+2C Si+2CO↑
Si+2CO↑
本题解析:
本题难度:一般
5、选择题 在元素周期表中非金属元素最多的区是
A.s区
B.p区
C.d区
D.ds区
参考答案:B
本题解析:正确答案:B
A、s区只有氢;B、正确;C.d区全是金属 D.ds区全是金属。
本题难度:一般