微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
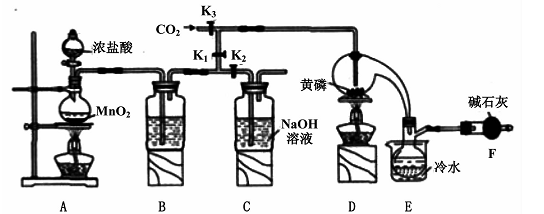
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3和HCl;遇O2会生成POCl3,POCl3溶于PCl3。PCl3、POCl3的熔沸点见下表:
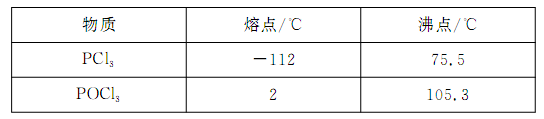
请回答下列问题:
(1)A装置中制氯气的离子方程式为 ?。
(2)B中所装试剂是?,E中冷水的作用是 ?,F中碱石灰的作用是?。
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是?。
(4)粗产品中常含有POC13、PCl5等。加入黄磷加热除去PCl5后.通过?(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00mL,向其中加入10.00 mL 0.1000 mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3,溶液滴定
④重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
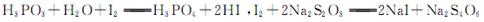 已知:?,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为?。
已知:?,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为?。
参考答案:(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)浓H2SO4;冷凝PCl3防止其挥发;吸收多余的氯气,防止空气中的水蒸汽进入烧瓶中和PCl3反应
(3)排尽装置中的空气,防止白磷自燃;
(4)蒸馏
(5)79.75%
本题解析:(1)二氧化锰和浓盐酸加热制取氯气;(2)干燥氯气用浓硫酸;根据表中PCl3的沸点可得,用冷水可以将其冷凝;根据信息可得PCl3不能遇见水蒸气,还要考虑进行尾气处理,故碱石灰的作用为吸收多余的氯气,防止空气中的水蒸汽进入烧瓶中和PCl3反应;(3)根据题目信息可知需要排尽装置内的空气;(4)根据题目信息可知利用沸点的不同将混合物分离,故蒸馏;(5)根据碘单质和Na2S2O3的反应求出剩余的碘单质,根据总的碘单质减去剩余的碘单质求出与H3PO3的物质的量,根据磷原子守恒得PCl3的物质的量,从而求出其质量分数。
本题难度:困难
2、选择题 等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中加入少量的CuSO4溶液,下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是(?)
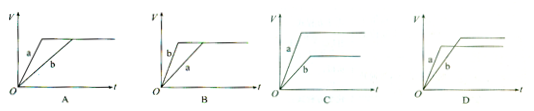
参考答案:D
本题解析:由于稀H2SO4是过量的,所以与Zn发生反应时放出的氢气按照Zn来计算。若其中的一份中加入少量的CuSO4溶液,就会发生反应:Zn+ CuSO4=ZnSO4+Cu.这样Zn、Cu及硫酸就形成了原电池,加快娿制取氢气的速率。但是由于消耗了一部分Zn,所以放出的氢气的量比不滴加要少一些。因此表示产生H2的体积(V)与时间(t)的关系正确的应该为D。
本题难度:一般
3、选择题 0.02 mol FeS2与一定浓度的硝酸完全反应,Fe元素和S元素全部转化为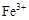 和
和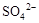 ,同
,同
时产生氮的氧化物(NO、NO2、N2O4)混合气体共0.25 mol,该混合气体的平均相对分子质量可能是
A.30
B.46
C.50
D.66
参考答案:BC
本题解析:根据电子守恒,0.02 mol FeS2,失电子总数:0.02*(1+14)=0.3mol,若产物全是NO,则为0.1mol,不可能。若产物全是NO2,物质的量为0.3mol这与混合气体共0.25 mol不符,不可能。若产物全是N2O4,物质的量为0.15mol这与混合气体共0.25 mol不符,不可能。所以产生气体的相对分子质量应该在(NO,NO2)和(NO2,N2O4)两种情况之间。若为(NO,NO2),设两者物质的量分别为:x,y,则有x+y="0.25,3x+y=0.3,x=0.025" y=0.225,求得M=(0.025*30+46*0.225)/0.25=44.4。若为(NO2,N2O4),设两者物质的量分别为:x,y,则有x+y="0.25,x+2y=0.3,x=0.2" y=0.05,求得M=(0.05*92+46*0.2)/0.25=55.2。即相对分子质量在44.4--55.2之间,故选BC。
本题难度:一般
4、选择题 在100m? L含等物质的量的HBr和H2SO3的溶液里通入0.025molCl2,有一半Br-变为Br2(已知Br2能氧化H2SO3? )。则原溶液中HBr和H2SO3的浓度都等于(?)
A.0.25mol·L-1
B.0.002mol·L-1
C.0.02mol·L-1
D.0.2mol·L-1
参考答案:D
本题解析:因为Br2能氧化H2SO3,所以H2SO3还原性较强。Cl2应先氧 化H2SO3再氧化HBr。设等物质的量的HBr和H2SO3的物质的量为。 ,充分反应后余下的氯气再和HBr反应。
,充分反应后余下的氯气再和HBr反应。 因为有一半Br-变为Br2,所以2*(0.025-a)mol=a/2?。所以可以求出a=0.002mol。可以求解:
因为有一半Br-变为Br2,所以2*(0.025-a)mol=a/2?。所以可以求出a=0.002mol。可以求解: 32->I->Fe2+>Br->Cl-这些离子的还原性的大小顺序。
32->I->Fe2+>Br->Cl-这些离子的还原性的大小顺序。
本题难度:一般
5、选择题 标准状况下,往100 mL 0.1 mol·L-1的FeBr2溶液中通入一定体积的Cl2,充分反应后,溶液中有50%的Br-被氧化。则通入的氯气的体积是( )
A.0.224 L
B.0.336 L
C.0.448 L
D.0.672 L
参考答案:A
本题解析:Fe2+的还原性强于Br-,所以Cl2先氧化Fe2+,再氧化Br-。溶液中有50%的Br-被氧化时则Fe2+完全被氧化。失电子数为0.01mol+0.02mol×50%=0.02mol,所以得电子数为0.02mol,氯气的物质的量为0.01mol,氯气的体积为0.224 L。
点评:本题根据得失电子数相等计算。
本题难度:一般