微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 由短周期元素组成的化合物X是某抗酸药的有效成分。甲同学欲探究X的组成。?
查阅资料:
①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、磷酸铝、碱式碳酸?镁铝?。?
②Al3+在pH=5.0时沉淀完全;? ?Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全。?
实验过程:?
Ⅰ.向化合物X粉末中加入过量盐酸,产生气体A,得到无色溶液。?
Ⅱ.用铂丝蘸取少量Ⅰ中所得的溶液,在火焰上灼烧,无黄色火焰。?
Ⅲ.向Ⅰ中所得的溶液中滴加氨水,调节pH至5?6,产生白色沉淀B,过滤。?
Ⅳ.向沉淀B中加过量NaOH?溶液,沉淀全部溶解。?
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C。?
(1)Ⅰ中气体A?可使澄清石灰水变浑浊,A的化学式是___________。?
(2)由Ⅰ、Ⅱ判断X一定不含有的元素是磷、___________?。
(3)Ⅲ中生成B的离子方程式是____________。
(4)Ⅳ中B溶解的离子方程式是_________。
(5)沉淀C的化学式是_________。
(6)若上述n(A)∶n(B)∶n(C)=1∶1∶3,则X的化学式是___________。?
参考答案:(1)CO2
(2)钠、硅
(3)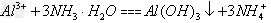
(4)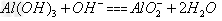
(5)
(6)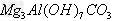
本题解析:
本题难度:一般
2、选择题 下列实验操作与实验目的或结论都正确的是
[? ]
实验操作
实验目的或结论
A.
用干燥洁净的玻璃棒蘸取氯水点在pH试纸上,待其变色
后和标准比色卡比较
测氯水的pH
B.
室温下,分别向2支试管中加入相同体积、相同浓度的
Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸
研究浓度对反应速率的影响
C.
下层液体从分液漏斗下端管口放出后,关闭活塞,换一
个接收容器,再将上层液体从下端管口放出
取出分液漏斗中的上层液体
D.
向某溶液中加入稀硝酸,无现象,再滴加Ba(NO3)2溶
液,产生白色沉淀
说明该溶液中一定含有SO42-
参考答案:B
本题解析:
本题难度:一般
3、实验题 北京市场销售的某种食用精制盐包装袋上有如下说明
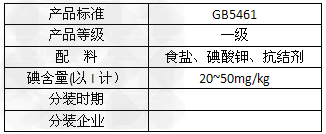
(1)碘酸钾与碘化钾在酸性条件下发生反应生成I2,I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是__________________。
②某学生设计回收四氯化碳的操作步骤为: ?
a.将碘的四氯化碳溶液置于分液漏斗中;?
b.加入适量Na2SO3稀溶液;?
c.分离出下层液体。
?以上设计中遗漏的操作及在上述步骤中的位置是_____________。
(2)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加蒸馏水使其完全溶解,得1L溶液;
b.取100mL溶液,用稀硫酸酸化,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_________mg/kg。
(3)将I2溶于KI溶液,在低温条件下,可制得KIO3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由________________________________。
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+:______________________________________。
参考答案:(1)①I2+SO32-+H2O===2I-+SO42-+2H+;②在步骤b后,增加操作:将分液漏斗充分振荡后静置
(2)4.2?×103/w
(3)否;KIO3在受热(或潮湿)条件下产生I2和KI,KI被氧气氧化,I2易升华
(4)取足量该加碘盐溶于蒸馏水中,用盐酸酸化,滴加适量氧化剂(如:氯水、过氧化氢等),再滴加KSCN溶液,若显血红色,则该加碘盐中存在Fe2+。
本题解析:
本题难度:一般
4、选择题 下列实验装置设计正确,且能达到目的的是
[? ]
A. 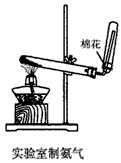
B. 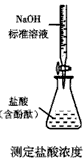
C. 
D. 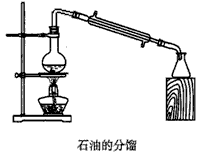
参考答案:A
本题解析:
本题难度:一般
5、选择题 某有机物在空气中完全燃烧只生成二氧化碳和水,则此有机物( )
A.一定含有氧元素
B.一定不含有氧元素
C.一定含有碳、氢、氧三种元素
D.一定含有碳、氢两种元素,不能确定是否含有氧元素
参考答案:D
本题解析:
本题难度:一般