微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组反应(表中物质均为反应物)中,产生H2速率最快的是( )
| 编号 | 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度/℃
A
Mg,0.1
5mol/L盐酸10mL
60
B
Mg,0.1
3mol/L盐酸10mL
60
C
Fe,0.1
3mol/L盐酸10mL
60
D
Mg,0.1
3mol/L盐酸10mL
50
|
A.A
B.B
C.C
D.D
参考答案:活泼性Mg>Fe,则C反应最慢,A、B、D相比较,A浓度最大,温度最高,则反应速率最大,故选A.
本题解析:
本题难度:简单
2、选择题 影响化学反应速率的因素很多,下列措施能加快化学反应速率的是( )
A.降低反应物浓度
B.降低温度
C.降低压强
D.升高温度
参考答案:A.降低反应物浓度,活化分子数目减少,反应速率减慢,故A不选;
B.降低温度,活化分子百分数减少,反应速率减慢,故B不选;
C.降低压强,活化分子数目减少,反应速率减慢,故C不选;
D.升高温度,活化分子百分数增多,反应速率加快,故D选;
故选D.
本题解析:
本题难度:一般
3、填空题 (9分)亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:
Na2SO3+KIO3+H2SO4 ==Na2SO4+K2SO4+I2+H2O,
(1)其中氧化剂是?,若反应中有5mol电子转移,则生成碘是________mol。
该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢)?②IO2-+ SO32-→IO-+SO42-(快)
③5I-+6H++ IO3-→3I2+3H2O(快)?④I2+ SO32-+ H2O→2I-+ SO42-+2H2(快)
(2)根据上述条件推测,此反应的总的反应速率由?步反应决定。
参考答案:(1)KIO3;0.5(2)①
本题解析:(1)根据方程式可知,碘酸钾中碘元素的化合价从+5价降低到0价,得到5个电子,所以碘酸钾是氧化剂;如果转移5mol电子,则生成碘单质是0.5mol。
(2)根据反应过程和机理可知,该反应的反应速率决定于反应速率最慢的那一步,所以答案选①.
本题难度:一般
4、选择题 硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+ H2O,下列各组实验中最先出现浑浊的是
[? ]
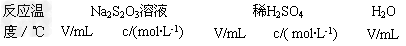
A. 25 5 0.1 10 0.1 ? ? 5
B. 25 5 0.2 5 0.2 10
C. 35 5 0.1 10 0.1 5
D. 35 5 0.2 5 0.2 10
参考答案:D
本题解析:
本题难度:一般
5、填空题 (9分)某探究小组通过比较酸性KMnO4溶液与H2C2O4溶液反应过程中,溶液紫色消失时间长短的方法,研究浓度、温度对反应速率的影响。
可供选择的实验条件:KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.1 mol·L-1,H2C2O4溶液的浓度可选择0.1 mol·L-1、0.2 mol·L-1,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)实验设计:请完成以下实验设计表。
实验编号
|  T/K T/K
| KMnO4浓度
/mol·L-1
| H2C2O4浓度
/mol·L-1
| 实验目的
|
①
| 298
| 0.01 mol·L-1
| 0.1 mol·L-1
| 为以下实验做对照
|
②
| ?
| ?
| ?
| ?
|
③
| ?
| ?
| ?
| 探究浓度对反应速率的影响
|
(2)实验记录:实验中需要记录的数据是?。
参考答案:(9分)(1)(7分)
实验编号
T/K
KMnO4浓度
/mol·L-1
H2C2O4浓度
/mol·L-1
实验目的
①
?
?
?
?
②
323
0.01 mol·L-1
0.1 mol·L-1
探究温度对反应速率的影响
③
298
0.01 mol·L-1
0.2 mol·L-1
?
本题解析:略
本题难度:一般