微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 (15分)现有A、B、C、D、E、F六种中学常见的元素,其原子序数依次增大。①D的一种含氧酸根离子与H+结合生成D的单质、D的氧化物和水;该D的氧化物通入品红溶液,溶液褪色,加热溶液又变红色;②在短周期元素中,只有C的氧化物和烧碱反应生成的溶液与过量盐酸混合产生白色沉淀;③A与D的原子最外层电子数相同;④B的单质既能与盐酸反应,又能与氢氧化钠溶液反应;⑤E有多种含氧酸,其氧化性与“同元素价态越高,其氧化性越强”一般规律相悖,它是生活调味品和农药的组成元素 ⑥E单质+F单质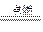 红棕色烟,D单质+F单质
红棕色烟,D单质+F单质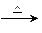 黑色固体,A单质+F单质
黑色固体,A单质+F单质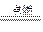 黑色固体。F的最高价钾盐是一种绿色环保型净水剂。
黑色固体。F的最高价钾盐是一种绿色环保型净水剂。
根据上述信息,回答下列问题:
(1)A的简单离子结构示意图为?;具有强氧化性的E的含氧酸结构式为?;
(2)向一定量的烧碱溶液中缓慢通入DA2,得到中性溶液,其溶质的化学式为?;
(3)下列“根据”能证明B、F单质活泼性强弱的是?;
a.根据它们分别与D单质反应产物的价态?
b.根据它们最高价氧化物的水化物在氢氧化钠溶液中溶解情况
c.根据它们分别与盐酸反应产生气泡快慢
d.根据它们在空气中稳定性
(4)工业上冶炼C单质的化学方程式为?。
(5)CE4在湿空气中产生大量白雾,可以用于海战。写出发生的化学方程式:?。
(6)C、D、E最高价氧化物对应的水化物酸性强弱顺序为(用化学式表示):?。
参考答案:(1)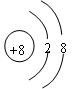 ? H-O-Cl? (4分)
? H-O-Cl? (4分)
(2)Na2SO3和NaHSO3(3分)
(3)c?(2分)
(4)SiO2+2C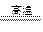 Si+2CO↑ (2分)
Si+2CO↑ (2分)
(5)SiCl4+3H2O=H2SiO3+4HCl↑(2分)
(6)HClO4>H2SO4>H2SiO3(H4SiO4)(2分)
本题解析:由①信息知,D的氧化物为二氧化硫,该含氧酸根离子为S2O32-,即D为硫;根据②信息,C的钠盐与过量盐酸反应产生白色沉淀,说明C的含氧酸难溶于水,又因为C在硫元素之前,硅酸是短周期元素中唯一一种难溶于水的酸,故C为硅;由信息③知,A与硫同主族,A为氧;由信息④推知,B为铝;根据信息⑤,E为氯,因为高氯酸中氯呈+7价,但高氯酸氧化性弱,而次氯酸具有强氧化性。由信息⑥知,F为铁,铁在氧气中燃烧产生黑色四氧化三铁,铁在氯气中燃烧生成红棕色氯化铁,铁与硫反应生成硫化亚铁。高铁酸钾(K2FeO4)或高铁酸钠(Na2FeO4)既能杀菌又能净水。(1)次氟酸、次氯酸、次溴酸、次碘酸分子中,氧与氢形成共价键,结构式为H-O-X,习惯写成HXO;(2)向氢氧化钠溶液中通入二氧化硫,得到溶液的溶质可能是:Na2SO3,NaOH(碱性);Na2SO3(碱性);NaHSO3(酸性);NaHSO3,H2SO3(酸性)等溶液都不可能呈中性,含亚硫酸钠和亚硫酸氢钠的溶液可能呈中性。(3)铝只有+3价,铁有+2价、+3价,不能根据铝、铁与硫反应生成产物价态判断铝比铁活泼;氢氧化铁不溶于氢氧化钠,氢氧化铝溶于氢氧化钠,但不能根据这一性质判断铁比铝活泼,最高价氧化物的水化物与碱反应情况只能判断同周期元素性质递变;接触面相近,金属与同浓度同种稀无氧化性酸反应,由反应剧烈程度判断金属活泼性强弱;铁在空气中易生锈,铝表面生成一层保护膜,性质稳定,不是因为铝本身性质稳定,由此不能判断铝、铁性质活泼性;(4)工业上用焦炭还原二氧化硅制备粗硅。
本题难度:一般
2、填空题 (8分)甲、乙、丙三种物质之间有如下转化关系:

(1)若甲是不溶于水的白色固体氧化物,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是________(填化学式);写出 乙→丙转化的离子方程式:_______________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是__________(填化学式);
写出甲→乙转化的离子方程式_________________________________________。
参考答案:(1)Al2O3 ;Al3++3NH3·H2O===Al(OH)3 ↓+3NH4+。
(2)Fe2O3;Fe2O3+6H+===2Fe3++3H2O 。
本题解析: ,
,
由以上的转化关系,同时已知甲是不溶于水的白色固体氧化物,既能溶于盐酸又能溶于氢氧化钠溶液,说明,甲是两性氧化物,所以甲一定是Al2O3 ,甲转化为乙,可知乙是硫酸铝,所以乙→丙转化的离子方程式是Al3++3NH3·H2O===Al(OH)3 ↓+3NH4+。

乙溶液中加入KSCN溶液,有红色出现,说明甲中含有三价铁,所以甲物质是Fe2O3;
所以甲→乙转化的离子方程式Fe2O3+6H+===2Fe3++3H2O。
点评:本题考查的是物质间的转化关系,此类问题一定要熟悉物质间的转化关系,如铁三角,铝三角等等。
本题难度:一般
3、填空题 已知A、B、C、D是中学化学的常见物质,它们在一定条件下有如下转
化关系:

(1)若A为能使湿润的红色石蕊试纸变蓝的气体,C为红棕色气体。则A的空间构型为?,A转化为B反应的化学方程式为?。
(2)若A、B、C均为氧化物,A为砖红色固体,且A中金属元素为+1价,D是一种黑色固态非金属单质,则A的化学式为?,B的电子式为??。
(3)若D为氯碱工业的主要产品,B为高中常见的一种具有两性的物质,则C溶液中除氢氧根外还存在的阴离子的化学式为?。氯碱工业中阴极的电极反应式为?。
参考答案:(1)三角锥 (1分)4NH3+5O2 ?4NO+6H2O?(2分,无条件或未配平各扣1分)
?4NO+6H2O?(2分,无条件或未配平各扣1分)
(2)Cu2O?(1分)?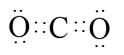 (2分)
(2分)
(3)AlO2-或Al(OH)4-?(1分)? 2H+ +2e-= H2↑或2H2O+2 e-= H2↑+2OH-?(2分)
本题解析:(1)若A为能使湿润的红色石蕊试纸变蓝的气体,则A是氨气,空间构型为三角锥形。C为红棕色气体,则C是NO2。所以D是氧气,B是NO。则A转化为B反应的化学方程式为4NH3+5O2 ?4NO+6H2O。
?4NO+6H2O。
(2)若A、B、C均为氧化物,A为砖红色固体,且A中金属元素为+1价,所以A是氧化亚铜,化学式是Cu2O。D是一种黑色固态非金属单质,则D是碳元素,所以B是CO2,C是CO,则B的电子式为 。
。
(3)若D为氯碱工业的主要产品,B为高中常见的一种具有两性的物质,则A是可溶性铝盐,D是氢氧化钠,B是氢氧化铝,C是偏铝酸钠,因此C溶液中除氢氧根外还存在的阴离子的化学式为AlO2-或Al(OH)4-。电解池中阴极得到电子,则是溶液中的氢离子放电,所以氯碱工业中阴极的电极反应式为 2H+ +2e-= H2↑。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,难易适中,侧重对学生基础知识的巩固与训练,同时也注重对学生答题能力的培养和方法指导,有利于培养学生的逻辑思维能力和发散思维能力。该类试题需要注意的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:困难
4、选择题 A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列判断正确的是(?)

A.X元素可能为Al
B.X元素可能为Si
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
参考答案:D
本题解析:从框图可以看出元素X应该有变价,反应①和②都属于氧化还原反应,Al和Si均无变价,反应①和②分别在碱性和酸性条件下进行,不是可逆反应,元素X可能为氯、溴、碘等元素。
本题难度:一般
5、简答题 A、B、C是单质,其中A是金属,各种物质间的转化关系如图:根据图示转化关系回答:
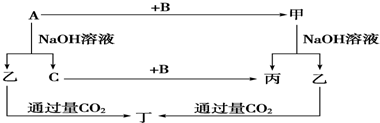
(1)写出下列物质的化学式.A______,B______,乙______,丁______.
(2)写出下列变化的化学方程式.
①A与NaOH溶液反应的化学方程式______.②甲与NaOH溶液反应的离子方程式______.
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36L,则消耗的A的物质的量为______,转移电子数目为______.
参考答案:常见金属单质中能与NaOH溶液反应产生气体的只有Al,所以A是Al,乙是NaAlO2,C是H2,甲是Al的化合物,可和NaOH溶液反应产生NaAlO2,甲可能是Al2O3,则丙是H2O,B即是O2,根据NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓得丁是Al(OH)3,则:
(1)由上述分析可知,A为Al,B为O2,乙是NaAlO2,丁是Al(OH)3;
故答案为:Al,O2,NaAlO2,Al(OH)3;
(2)①Al与NaOH溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
②Al2O3与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O;
故答案为:Al2O3+2OH-═2AlO2-+H2O;
(3)产生的H2在标准状况下的体积为3.36L,物质的量为3.36L22.4L/mol=0.15mol,根据2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,消耗的Al的物质的量为0.15mol×23=0.1mol,转移电子数目为0.1mol×3×NAmol-1=0.3NA;
故答案为:0.1mol,0.3NA.
本题解析:
本题难度:一般