微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知:E为常见金属单质,C、D、F、I均为常见气体,其中C、D为单质,F、I为化合物,且组成元素相同,D、F有毒,I为直线型非极性分子,它们有如下框图关系:

(1)反应①阳极的电极反应式?。
(2)反应③的化学方程式?,
(3)反应④的离子方程式为?。
(4)K是一种难溶于水的固体,K受热分解可生成H。实现由G溶液到K的转化时可以加入的试剂是(填写选项字母)?
A.NaOH溶液?B.氨水 ?C.Na2CO3溶液?D.NaHCO3溶液
(5)将G的饱和溶液加入到沸水中,继续加热可得红褐色液体,写出反应的离子方程式:??
该液体接通直流电后___? __极附近颜色加深,这种过程叫做____? _。
(6)若E中含有合金元素,会导致G不纯。测定G的质量分数通常可用碘量法测定:称取mg无水G样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I- +S4O62-),共用去VmL。(杂质不参与反应) 则样品中G的质量分数为:? ??。
则样品中G的质量分数为:? ??。
参考答案:
本题解析:略
本题难度:一般
2、简答题 a、b、c、d、e是含有一种相同元素的五种物质,可发生如图转化:其中:a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物.
(1)如果a是一种淡黄色粉末固体,试推断这五种物质(用名称表示):
a______;b______;c______;d______;e______.
并写出由c生成d的化学方程式______
(2)如果a为单质且是一种常见气体,试推断这五种物质(用化学式表示):
a______;b______;c______;d______;e______.
并写出由d生成e的化学方程式______.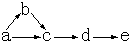
参考答案:淡黄色单质为硫,题中能发生连续氧化,对应的反应有硫和氮元素的转化:
(1)a物质是淡黄色粉末,且能够被连续两次氧化,所以a物质是非金属硫,b为硫化氢,c为二氧化硫,d为三氧化硫,e为硫酸,c生成d的反应为2SO2+O2催化剂
本题解析:
本题难度:一般
3、简答题 已知与外加电源正极相连的电极为电解池的阳极,与外加电源负极相连的电极为电解池的阴极,在以石墨为电极电解时,电解质溶液中的阴离子在阳极发生氧化反应,电解质溶液中的阳离子在阴极发生还原反应,又知阳离子得电子的能力与其对应金属的金属活动性顺序相反(注意:Fe3+>Cu2+>Fe2+),阴离子失电子的能力为S2->I->Br->Cl->OH->含氧酸根离子>F-.如图所示:以石墨为电极电解A的水溶液,并做下面一系列实验,试根据实验现象完成下列问题.电解质A的水溶液焰色反应呈浅紫色.
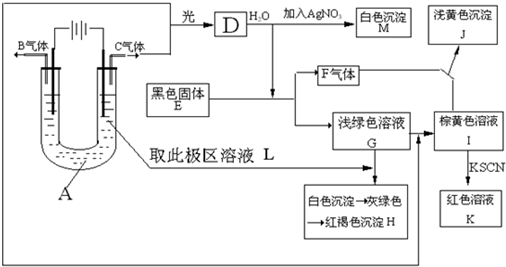
(1)写出A的化学式为______,E的名称为______.
(2)I与F作用的离子方程式是______
(3)G加入L后产生的白色沉淀到生成红褐色沉淀H的化学方程式:______
(4)用两个最直接的离子方程式来证明Fe3+、Cu2+、Fe2+的氧化性强弱顺序是Fe3+>Cu2+>Fe2+
①______,②______.
参考答案:电解质A的水溶液焰色反应呈浅紫色,由此可知电解质A含有钾元素;二价铁离子显浅绿色,所以G含二价铁离子,G和L反应生成H,根据实验现象知,H 是氢氧化铁,所以溶液L含氢氧根离子,即电解A后,电解液中含有氢氧根离子;C和G反应生成I,I和硫氰化钾反应生成红色溶液K,三价铁离子显黄色,所以I含三价铁离子,二价铁离子和C反应生成三价铁离子,所以C是氯气,I是氯化铁溶液,G是氯化亚铁溶液,所以A是氯化钾;电解氯化钾溶液时,生成物是氯气、氢气和氢氧化钾,所以B是氢气,L是氢氧化钾溶液;B和C光照生成D,氢气和氯气光照生成氯化氢,所以D是氯化氢;氯化氢溶于水得盐酸,盐酸和硝酸银反应生成白色沉淀氯化银,所以M是氯化银;黑色固体E和盐酸反应生成硫化亚铁和气体F,F和氯化铁反应生成淡黄色沉淀J,淡黄色固体有过氧化钠、硫、和溴化银;过氧化钠在溶液中不存在,所以不是过氧化钠,氯化铁和气体不能生成溴化银,所以淡黄色沉淀是硫,黑色固体是硫化亚铁,气体F是硫化氢气体.
(1)通过以上分析知,A为KCl;E是硫化亚铁.
故答案为:A:KCl?E:硫化亚铁.
(2)通过以上分析知,I是氯化铁溶液,F是硫化氢,氯化铁有氧化性,硫化氢有还原性,所以氯化铁和硫化氢能发生氧化还原反应生成氯化亚铁和硫单质、盐酸,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+.
故答案为:2Fe3++H2S=2Fe2++S↓+2H+.
(3)通过以上分析知,G是氯化亚铁溶液,L是氢氧化钾溶液,氯化亚铁和氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁不稳定,能被空气中的氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 .
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 .
(4)因为Fe3+、Cu2+、Fe2+的氧化性强弱顺序是Fe3+>Cu2+>Fe2+,所以只要在同一反应方程式中Fe3+作氧化剂,
Cu2+作氧化产物即可证明三价铁离子的氧化性大于铜离子的氧化性,2Fe3++Cu=2Fe2++Cu2+;?在另一反应方程式中,铜离子作氧化剂,亚铁离子作氧化产物即可证明铜离子的氧化性大于亚铁离子的氧化性Fe+Cu2+=Fe2++Cu.
故答案为:2Fe3++Cu=2Fe2++Cu2+;Fe+Cu2+=Fe2++Cu.
本题解析:
本题难度:一般
4、简答题 物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:

(1)A元素的原子结构示意图为______.
(2)写出下列物质的化学式:E是______,K是______.
(3)化合物B属于______化合物(填“离子”或“共价”).
(4)实验室检验J中所含的金属离子时,常在J的溶液中加入______溶液.
(5)写出反应“F→G”的化学方程式:______;
(6)写出反应“I→J”的离子方程式:______.
参考答案:K为红褐色沉淀,则应为Fe(OH)3,则溶液J中含有Fe3+,所以H为Fe,D应为H2,E应为Cl2,B为HCl,则I为FeCl2,J为FeCl3,K为Fe(OH)3,白色沉淀F能溶于过量NaOH溶液,则F为Al(OH)3,G为NaAlO2,A为Al,C为AlCl3,
(1)A为Al,原子核外有3个电子层,最外层电子数为3,则原子结构示意图为

,
故答案为:

;
(2)由以上分析可知E为Cl2,K为Fe(OH)3,故答案为:Cl2;Fe(OH)3;
(3)B为HCl,为共价化合物,故答案为:共价;
(4)J为FeCl3,加入硫氰化钾发生颜色反应,溶液呈红色,加入氢氧化钠溶液,生成氢氧化铁红褐色沉淀,
故答案为:硫氰化钾溶液或氢氧化钠溶液;
(5)F为Al(OH)3,G为NaAlO2,反应“F→G”的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(6)I为FeCl2,J为FeCl3,反应“I→J”的离子方程式为2Fe2++Cl2=2Fe2++2Cl-,
故答案为:2Fe2++Cl2=2Fe2++2Cl-.
本题解析:
本题难度:一般
5、填空题 (现有部分短周期元素的性质或原子结构如表:
| 元素编号 | 元素性质或原子结构
A
该元素的一种原子,原子核中没有中子
B
有三个电子层,且K、M层电子数之和等于L层电子数
C
单质为双原子分子,其氢化物的水溶液呈碱性
D
元素最高正价是+7价
E
1mol?E的单质与足量的稀盐酸反应,可得到氢气33.6L?(标准状况)
|
(1)写出B元素在元素周期表中的位置______.
(2)写出C元素气态氢化物的电子式______.
(3)元素D与元素B相比,非金属性较强的是______(用元素符号表示),下列叙述中能证明这一事实的是______(填数字序号).
①常温下D的单质和B的单质状态不同
②D的气态氢化物比B的气态氢化物稳定
③B元素最高价氧化物的水化物酸性强于D元素最高价氧化物的水化物酸性
(4)由表中元素形成的常见物质X、Y、Z、M、N存在以下转化关系:

①N的化学式为______.
②X溶液与Y溶液反应的离子方程式为______.
参考答案:A:该元素的一种原子,原子核中没有中子,所以氢元素;
B:K层和M层上电子数之和等于L层上电数子,所以,次外层是K层,最外层是M层,K层排2个电子,L层排8个电子,M层排6个电子,所以是硫元素;
C:常温下单质为双原子分子,其氢化物水溶液呈碱性,所以是氮元素;
D:由最高正价为+7价,主族元素的族序数=其最外层电子数,且是短周期元素,氟没有正化合价,所以是氯元素.
E:1mol?E的单质与足量的稀盐酸反应,可得到氢气33.6L?(标准状况),根据电子得失守恒,可知E的化合价为+3价,为铝元素.
(1)硫元素的原子结构示意图:

,位于周期表:第三周期 第ⅥA族,故答案为:第三周期第ⅥA族;
(2)C元素气态氢化物为NH3,其电子式为:

,故答案为:

;
?(3)根据同周期非金属性质的变化规律及比较非金属性的方法来分析,Cl的非金属性比S元素强,Cl的氢化物比S的氢化物稳定、Cl元素最高价氧化物的水化物酸性强于S元素最高价氧化物的水化物酸性则说明Z的非金属性强,故答案为:Cl;②;
(4)根据白色沉淀M加热得到Z,可知M为氢氧化铝,N为氧化铝,再根据X+Y+H2O=Al(OH)3+M(只含非金属的盐),可知M为铵盐,这是实验室制备氢氧化铝的一种常见方法.
①因N为氧化铝,化学式:Al2O3,故答案为:Al2O3;
②氯化铝能于氨水反应得到氢氧化铝和氯化铵:AlCl3++3NH3?H2O═Al(OH)3↓+3NH4Cl.
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+.
本题解析:
本题难度:一般