| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《化学反应与能量》高频考点特训(2017年练习版)(四)
参考答案:D 本题解析:A、反应①是放热反应,因此①的反应物总能量高于生成物总能量,A错误;B、根据反应不能确定氧化钠与过氧化钠的能量高低,因此不能比较二者的稳定性,B错误;C、Na与氧气在加热时生成过氧化钠,常温下生成氧化钠,C错误;D、已知:25℃、101kPa 下:①2Na(s)+1/2O2(g) 本题难度:一般 4、选择题 已知下列四个热化学方程式: |
参考答案:C
本题解析:H2S完全燃烧生成液体水时放出的热量最多,但放热越多,△H越小,因此最小△H2,其次是△H1;H2S不完全燃烧放出的热量少,其中生成气态水放热最少,所以△H3最大,其次是△H3,因此△H四者的关系中正确的是△H3>△H4>△H1>△H2,答案选C。
考点:考查反应热大小比较的判断
本题难度:一般
5、填空题 Ⅰ.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。下表为一些化学键的键能数据
| 化学键 | Si-Si | O=O | Si-O |
| 键能/kJ·mol-1 | a | b | c |

 2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。
2NH3(g);△H<0,反应达到平衡后,测得混合气体为7体积。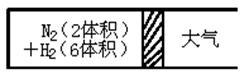
参考答案:Ⅰ.Si(s)+O2(g) SiO2(s) △H=(2a+ b - 4c)kJ/mol(2分)
SiO2(s) △H=(2a+ b - 4c)kJ/mol(2分)
Ⅱ.(1)A 池 2H+ +2I-=H2↑ + I2(2分) B 池 4Fe3+ + 2H2O=4Fe2+ + O2↑+ 4H+(2分)
(2)0.300mol(2分)
Ⅲ.(1)① 3 (2分)逆(1分)② 1<c≤4 (2分)
(2)降低温度 (1分) 降低温度平衡向正反应方向移动,气体总分子数减少(2分)
本题解析:Ⅰ.硅是原子晶体,平均1个硅原子形成2个Si-Si键。二氧化硅是原子晶体,平均1个硅原子形成4个Si-O键。又因为反应热等于断键吸收的能量与形成化学键所放出的能量的差值,因此硅高温燃烧的热化学方程式为Si(s)+O2(g) SiO2(s) △H=(2a+ b - 4c)kJ/mol。
SiO2(s) △H=(2a+ b - 4c)kJ/mol。
Ⅱ.(1)电解池左边放出氢气,氢离子在此得到电子,发生还原反应,则碘离子失去电子发生氧化反应,故A池中总反应式为2H+ +2I-=H2↑ + I2;电池右侧放出氧气,说明溶液中的氢氧根失去电子发生氧化反应,则溶液中的铁离子得到电子发生还原反应,因此B池总反应式为4Fe3+ + 2H2O=4Fe2+ + O2↑+ 4H+。(2)若电解池A中生成3.36 L H2(标准状况),其中氢气的物质的量是3.36L÷22.4L/mol=0.15mol,转移电子0.3mol,所以根据得失电子守恒可知B池中生成亚铁离子的物质的量是0.3mol。
Ⅲ.(1)①反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同,恒温恒压条件下,采用极限分析法,c体积的氨气完全转化为氮气和氧气之比是1:3,所以只要a:b=2:6,则b=3a=3,因反应前混合气体为8体积,反应后混合气体为7体积,体积差为1体积,由差量法可解出平衡时氨气为1体积;而在起始时,氨气的体积为c=2体积,比平衡状态时大,为达到同一平衡状态,氨的体积必须减小,所以平衡逆向移动;
②若需让反应逆向进行,由上述①所求出的平衡时氨气的体积为1可知,氨气的体积必须大于1,最大值则为2体积氮气和6体积氢气完全反应时产生的氨气的体积,即为4体积,则1<c≤4;
(2)根据6.5<7可知,上述平衡应向体积缩小的方向移动,即向放热方向移动,所以采取降温措施,这是由于降低温度平衡向正反应方向移动,气体总分子数减少。
考点:考查热化学方程式的书写、电化学原理的应用、以及可逆反应的有关计算与判断
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《硝酸》高频.. | |