微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题
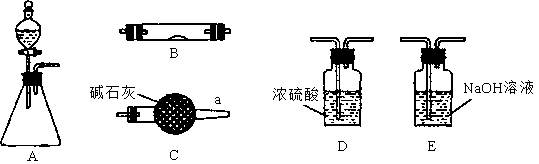
(1)若锥形瓶中盛装锌片,分液漏斗中盛装稀硫酸,可验证H2的还原性并检验其氧化产物。
①当仪器连接顺序为A→D→B→B→C时,两次使用B装置,其中所盛的药品依次是CuO、?。
②检查好装置的气密性后加热B前必须进行的操作是?。
(2)若锥形瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,B中盛装固体催化剂,可进行氨的催化氧化,其反应产物为NO和H2O。
装置B中可能观察到的现象是?。
(3)若锥形瓶中盛装Na2SO3固体,分液漏斗中盛装H2SO4溶液,B中盛装Na2O2固体,可探究SO2气体与过氧化钠反应时是否有O2生成。根据气流方向,从图中选择适当的仪器进行实验,装置的连接顺序为(填字母):装置B中可能观察到的现象是?。
参考答案:
(1)①无水硫酸铜②氢气验纯
(2)催化剂保持红热状态;在过量氧气存在是还有红棕色气体产生
(3)淡黄色变为白色
本题解析:(1)①Zn与稀硫酸反应产生的氢气,中含有H2O蒸气,因此用检验H2的氧化产物H2O来验证氢气的还原性,必需使用干燥的氢气,氢气首先通过浓硫酸进行干燥,并通过无水硫酸铜检验干燥后的气体是否还含有水蒸气;干燥后的气体通过灼热的氧化铜,然后将反应后的气体通入盛有无水硫酸铜的装置,判断水的生成。②由于氢氧混合气加热容易爆炸,因此加热前需要对氢气验纯。
(2)各装置的作用是,A装置,产生NH3和O2;C装置,干燥混合气体;B装置,NH3与O2催化氧化生成NO;C装置,吸收尾气,防止污染环境。NH3催化氧化为放热反应,因此可以看到催化剂保持红热状态;在过量氧气存在是还有红棕色气体产生。
(3)因为要检验SO2与Na2O2的反应,所以产生的SO2必需保证完全干燥,即SO2气体通过浓硫酸干燥,再通过盛有过氧化钠的装置,由于SO2污染大气,应添加尾气处理装置C,吸收SO2,但不能盛有E装置,因为E装置可能会有水蒸气与Na2O2反应。过氧化钠与SO2反应后,由淡黄色变为白色。
本题难度:简单
2、实验题 (12分)实验室可利用乙醇、铜或铜的化合物制备乙醛,下图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出)。试回答:
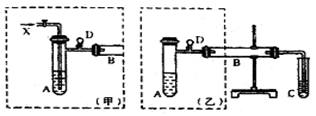
(1)在仪器组装完成后,加装试剂前必须要进行的操作是?;
(2)两套装置中的A、B处都需加热,A处用水浴加热,B处用?加热,A处用水浴加热的主要优点是?。
(3)若按甲装置进行实验,B管处装铜粉,则通入A管的X是?,B中反应的化学方程式为?。
(4)若按乙装置进行实验,则B管中应装?,
B中反应的化学方程式为?。
(5)实验结束后,将C试管中的溶液滴入新制的氢氧化铜溶液中并加热,可观察到的
现象?,写出该过程的化学方程式?。
参考答案:(方程式2分一空,其余一分一空)
(1)检查装置的气密性
(2)酒精灯?试管受热均匀,产生气体速度平稳
(3)氧气或空气?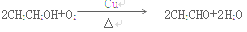
(4)氧化铜?
(5)有红色沉淀生成?
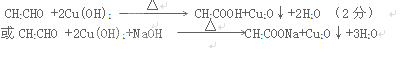
本题解析:(1)实验开始前,为确保实验的成功,必须检查装置的气密性;
(2)加热时,B处反应为乙醇的催化氧化,用酒精灯直接加热;
A处水浴加热的优点:试管受热均匀,便于控制反应温度以便得到平衡的气流;
(3)乙醇的催化氧化需要氧化剂氧气,则则通入A管的X是氧气或空气,其反应方程式为:
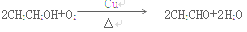
(4)由于装置乙无法持续通入氧气,所以,B管中装的药品为氧化铜;其反应方程式为:
 ;
;
(5)实验结束后,将C试管中的溶液为乙醛,能与新制的氢氧化铜反应,其方程式为:
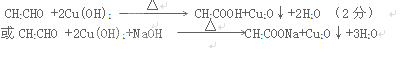
本题难度:一般
3、填空题 (12分)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤。
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤。
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬。
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀。
⑤? ▲?。
⑥? ▲?。
⑦蒸发、冷却结晶并从溶液中分离出晶体。
⑧用少量乙醇洗涤并凉干。
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:?▲ ?。
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是:? ▲?。
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2~4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp= 2.64×10?39)。下列说法正确的是? ▲?(选填序号)。
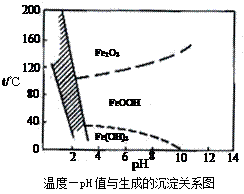
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10?29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85~95℃生成黄铁矾钢,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是:? ▲?。
(5)补充上述步骤⑤和⑥(可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸)。
参考答案:(12分)
(1)S2-+2H+=H2S↑(2分)
(2)减少过氧化氢的分解(2分)
(3)cd (2分,漏选得1分,错选不给分)
(4)上层清液呈无色(答静置后 向上层液中再加入Na2CO3溶液后没有沉淀生成也给分)(2分)
向上层液中再加入Na2CO3溶液后没有沉淀生成也给分)(2分)
(5)⑤过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性(2分)。
⑥向沉淀中加6mol/L的H2SO4溶液,直至恰好完全溶解(2分)
本题解析:略
本题难度:一般
4、实验题 (8分) 下图是实验室制备乙酸乙酯的实验装置。试回答:
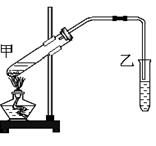
(1)试管甲中加入的试剂顺序是(?)
A.乙醇、浓硫酸、乙酸
B.浓硫酸、乙醇、乙酸
C.浓硫酸、乙酸、乙醇
(2)甲处的试管内发生反应的化学方程式为:?
(3)小试管乙中饱和Na2CO3的作用是(? )
A、吸收乙醇
B、中和乙酸
C、增大溶液密度,降低乙酸乙酯在里面的溶解度
(4)乙装置中的导管未插入溶液的目的是?。
参考答案:
(1)A
(2)CH3COOH+CH3CH2OH =CH3COOCH2CH3+H2O
=CH3COOCH2CH3+H2O
(3)ABC
(4)防止倒吸
本题解析:略
本题难度:简单
5、选择题 下列气体实验中,正确的是?(?)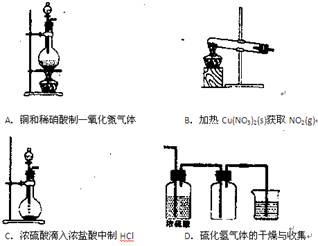
参考答案:AC
本题解析:硝酸铜受热分解产生的气体很复杂,有氧气、二氧化氮等,所以B错;硫化氢是还原性气体,不能用浓硫酸干燥,能发生氧化还原反应。所以D错。
本题难度:一般