微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 X是一种重要的工业原料, X在160℃分解制备异氰酸和氨气,反应方程式为:X  ?HCNO + NH3(已配平)。完成下列填空:
?HCNO + NH3(已配平)。完成下列填空:
(1)在上述反应所涉及的各元素中,原子半径最大的元素是_________,其原子核外电子共占据_______个轨道。
(2)在上述物质中有三种元素处于同周期,下列叙述中能说明三种元素C,N,O非金属性递变规律的事实是____________。
a.最高价氧化物对应水化物的酸性
b.单质与H2反应的难易程度
c.两两形成化合物中元素的化合价
工业上在催化剂条件下,用NH3作为还原剂将烟气中的NOx还原成无害的氮和水,反应方程式可表示为:
2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)
(3)一定条件下该反应在容积为2L的容器内反应,20 min时达到平衡,生成N2 0.4 mol,则平均反应速率υ(NO)=__________mol/L·min。
(4)当该反应达到平衡时,下列说法一定错误的是___________。
a.气体密度不变? b.气体颜色不变
c.υ(NO)正= 2υ(N2)逆? d.N2和NH3的浓度相等
(5)X可以代替NH3还原烟气中的NOx,X的分子模型如图所示,X电子式为______________。

(6)氰酸有两种结构,一种分子内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。请分别写出氰酸和异氰酸的结构式:_______________、______________。
参考答案:(1)C(1分),4个(1分)
(2)c(2分)
(3)0.005mol/(L·min)?(2分)
(4)c(2分)
(5)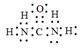 (2分)
(2分)
(6)
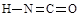 (2分)
(2分)
本题解析:根据X  ?HCNO + NH3(已配平)反应,可知X中含有C,H,O,N元素。
?HCNO + NH3(已配平)反应,可知X中含有C,H,O,N元素。
(1)各元素中,原子半径最大的元素是碳,其原子核外电子共占据4个轨道分别是1S22S22P2,其中S轨道2个,P轨道2个。
(2)元素非金属性递变规律的事实可能通过c.两两形成化合物中元素的化合价来判断,由于氧元素没最高价氧化物对应水化物,故也无法通过单质与H2反应的难易程度来判断。正确答案为bc。2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)
(3)一定条件下该反应在容积为2L的容器内反应,20 min时达到平衡,生成N2 0.4 mol,则平均反应速率υ(NO)=0.4/(2*20)*2="_0.005mol/(L·min)" 。
(4)a.气体密度始终不变,不能做为判断依据。b.气体颜色不变即浓度不变,正确。c.υ(NO)正= 2υ(N2)逆比值关系错误,错误。d.N2和NH3的浓度相等不一定平衡,正确。故选C。
(5)X电子式为 。
。
(6)根据信息氰酸和异氰酸的结构式
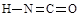 。
。
本题难度:一般
2、选择题 下列物质分类中,按物质的分类后者从属于前者的是
A.金属、非金属、稀有气体
B.碱、碱性氧化物、碱式盐
C.化合物、盐、酸式盐
D.混合物、化合物、纯净物
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列关于元素的叙述正确的是(?)
A.只有金属与非金属元素才能形成离子化合物
B.质子数与核外电子数相等的微粒一定是原子
C.简单离子最外层电子数只能是2或8
D.元素周期表中共有18列,分为16个族
参考答案:D
本题解析:A错,如铵盐均由非金属元素组成;B错,如分子;C错,如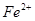 离子;D正确;
离子;D正确;
本题难度:简单
4、选择题 几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是(?)
元素代号
| A
| B
| D
| E
| G
| I
| J
| K
|
化合价
| –1
| –2
| +4
–4
| –1
| +5
–3
| +3
| +2
| +1
|
原子半径/nm
| 0.071
| 0.074
| 0.077
| 0.099
| 0.110
| 0.143
| 0.160
| 0.186
|
?
A.A的单质能将E单质从KE的溶液中置换出来?
B.A、I、J的离子半径由大到小顺序是A>J>I
C.G元素的单质不存在同素异形体
D.J在DB2中燃烧生成两种化合物
参考答案:B
本题解析:A、根据元素周期律中原子半径、化合价的变化规律,A、E是第七主族元素,且A的原子半径小于E,所以A是F元素,E是Cl元素,氟单质不能置换氯气,因为氟单质极易与水反应,错误;B、I、J分别是+3、+2价,且J的原子半径大于I,所以J是第二主族元素,I是第三主族元素,二者的原子半径都大于E,所以J是Mg、I是Al元素,则A、I、J的离子结构相同,根据半径的比较原则,离子半径由大到小顺序是A>J>I,正确;C、G最高价为+5价,为第五主族元素,其原子半径比E大,所以G是P元素,存在同素异形体,白磷、红磷,错误;D、根据B、D的化合价和半径大小判断B是O元素,D是C元素,则Mg在二氧化碳中燃烧生成单质碳和氧化镁,错误,答案选B。
本题难度:一般
5、选择题 元素X的原子核外M电子层上有3个电子,元素Y2-的离子核外有18个电子,则这两种元素可形成的化合物为(?)
A.XY2
B.X2Y3
C.X3Y2
D.XY2
参考答案:B
本题解析:元素X的原子核外M电子层上有3个电子,则X是13号元素,是Al元素。元素Y2-的离子核外有18个电子,则Y是S元素。所以这两种元素可形成的化合物为Al2S3,答案选B。
点评:该题是中等难度的试题,主要是考查学生对元素化合价和最外层电子数关系的了解掌握情况,旨在培养学生灵活运用基础知识解决实际问题的能力,也有助于培养学生的逻辑推理能力,提高学生的应试能力。
本题难度:一般