微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (12分)全世界每年被腐蚀损耗的钢铁约占全年钢铁产量的1/10,而在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1)在潮湿空气中,钢铁发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为? ▲?。
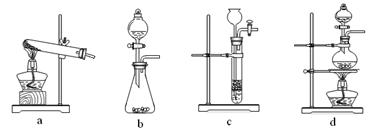
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4 CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是? ▲?。(填字母)
CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是? ▲?。(填字母)
(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
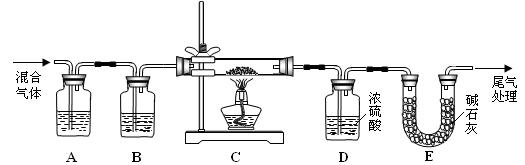
①为得到干燥、纯净的CO气,洗气瓶A、B中盛放的试剂分别是? ▲?、? ▲?。
②在点燃酒精灯之前应 进行的操作是:(a)检查装置气密性;(b)? ▲?。
进行的操作是:(a)检查装置气密性;(b)? ▲?。
③准确称量样品的质量10.00 g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n =? ▲?。
④在本实验中,下列情况会使测定结果n偏大的是? ▲?。(填字母)
a.缺少洗气瓶B? b.缺少装置E? c.反应后固体是铁和少量Fe2O3·nH2O
参考答案:共12分。
(1)2Fe + O2 + 2H2O =2Fe(OH)2(2分)?(2)d(2分)
+ 2H2O =2Fe(OH)2(2分)?(2)d(2分)
(3)?①浓NaOH溶液(1分)?浓硫酸(1分)
②通入混合气体一段时间(2分)?③2(2分)?④ a(2分)
本题解析:略
本题难度:简单
2、实验题 (15分)氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,用KMnO4、KClO3氧化浓盐酸可快速制取氯气.根据上述反应原理,有人提出能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢.某课外小组在实验室进行了探索性实验,设计了如图装置:
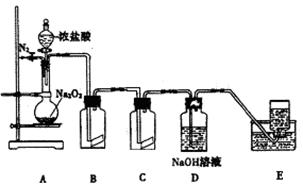
操作步骤及现在如下:
①组装好装置,检查装置的气密性,加入药品.
②缓慢通入一定量的N2后,将装置E连接好(导管未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体.
③一段时间后,将导管末端伸入集气瓶中收集气体.装置E中收集到能使带火星的木条复燃的无色气体.
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色.
回答下列问题:
⑴写出KClO3氧化浓盐酸制取Cl2的离子方程式?
⑵装置B中湿润的红色布条褪色,说明A中有 (填化学式)生成,装置C中为湿润的KI-淀粉试纸,能否仅通过试纸变蓝证明上述结论,请用离子方程式说明原因
⑶装置D的作用是
⑷写出生成O2的可能的反应方程式
⑸实验证明,Na2O2甚至能与干燥的HCl反应生成氯气,写出反应的化学方程式
综合上述实验,请分析实验室??(填”能”或”否”)利用Na2O2与浓盐酸反应制备纯净的Cl2,理由是
参考答案:(1)ClO3-+5Cl-+6H+=3Cl2↑+3H2O(2分)
(2)Cl2(2分) 4H+ + 4I-+ O2 ="==" 2I2 + 2H2O(2分,写2H2O + 4I-+ O2 ="==" 2I2+4OH-得1分)
(3)吸收HCl和过量的Cl2,防止污染空气,使E中能收集到较为纯净的氧气(2分)
(4)2Na2O2 + 2H2O="=4NaOH+" O2(2分)
(5)? Na2O2 + 4HCl ="=" Cl2?+ 2NaCl + 2H2O(2分)否(1分)?
①Na2O2与生成的H2O反应有O2生成;HCl混在Cl2中;H2O混在Cl2中(1分)(答出任何一点即可)
②实验室没有可直接使用的干燥HCl气体;固体与气体反应较慢(1分)(答出任何一点即可,其他合理答案均可)
本题解析:(1)氯酸钾氧化浓盐酸的氧化产物和还原产物都是氯气,方程式为
ClO3-+5Cl-+6H+=3Cl2↑+3H2O。
(2)装置B中湿润的红色布条褪色,说明有次氯酸产生,所以A中有氯气生成。由于过氧化钠和水反应也生成氧气,二氧化也能氧化碘化钾,生成单质碘,所以不能仅通过试纸变蓝证明上述结论。氯气溶于水显酸性,所以方程式为4H+ + 4I-+ O2 ="==" 2I2 + 2H2O。
(3)氯气有毒,需要尾气处理。另一方面也保证最后得到的是纯净氧气,即作用是吸收HCl和过量的Cl2,防止污染空气,使E中能收集到较为纯净的氧气。
(4)过氧化钠溶于水即生成氧气,方程式为2Na2O2 + 2H2O="=4NaOH+" O2。
(5)过氧化钠氧化氯化氢的生成物是氯气,还原产物是水,所以方程式为Na2O2 + 4HCl ="=" Cl2?+ 2NaCl + 2H2O。由于在生成氯气的同时,还会生成氧气,所以得不到纯净的氯气。
本题难度:一般
3、实验题 下图是一个实验室制取氯气并以氯气为原料进行特定反应的装置图。
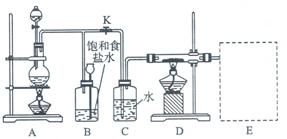
(1)A是氯气发生装置,其中发生反应的离子方程式为 ?。
(2)实验开始时,先点燃A处酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。则该反应的化学方程式为??,装置C的作用是?
(3) 该装置图尚未画完,请在E处补充完整,并注明试剂名称。
(4)D处反应完结后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,则B的作用是?。
参考答案:(1) MnO2+4H++2Cl- Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑
(2)? C+2Cl2+2H2O CO2+4HCl?,?提供水蒸汽?
CO2+4HCl?,?提供水蒸汽?
(4) 储存氯气
本题解析:(1) MnO2+4H++2Cl- ?Mn2++2H2O+Cl2↑ 注意MnO2写化学式,浓盐酸拆成离子形式,注意配平。(2)C+2Cl2+2H2O
?Mn2++2H2O+Cl2↑ 注意MnO2写化学式,浓盐酸拆成离子形式,注意配平。(2)C+2Cl2+2H2O  ?CO2+4HCl,C提供水蒸汽(3)注意收集气体装置。
?CO2+4HCl,C提供水蒸汽(3)注意收集气体装置。
(4)B的作用是储存氯气
点评:氯气的制取实验是历年高考的重点和难点,本题在旧的知识上有新的拓展,注意氯气的制备装置,即可找到突破口。
本题难度:一般
4、填空题 今有HCl、C12、H2S、NH3、NO2、CO2、H2、SO2等气体,问:
(1)不能用浓硫酸干燥的是____________________、___________________________
(2)比空气轻的气体是___________、_______________
(3)用水作溶剂,可作喷泉实验的氢化物是________、_______________
(4)能使品红试纸褪色的是_______________、______________。
参考答案:(1) H2S? NH3?(2)NH3? H2
(3)HCl? NH3?(4)SO2? Cl2
本题解析:(1)浓硫酸具有吸水性、脱水性、强氧化性,而H2S具有还原性能被浓硫酸氧化,NH3具有碱性,能与酸发生反应;
(2)利用空气的平均相对分子质量为29,气体的相对分子若比29小,即密度比空气小,所以比空气轻的气体是:NH3? H2;
(3)由于HCl? NH3极易溶于水,当用水作溶剂,可作喷泉实验;
(4)能使品红试纸褪色的是SO2? Cl2
本题难度:一般
5、实验题 利用如图装置探究氯气和氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为较纯净干燥的氯气与氨气反应的装置。
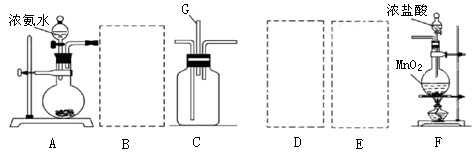
请回答下列问题:
(1)装置F中发生反应的离子方程式为?。
(2)装置A中的烧瓶内固体宜选用?(选填以下选项的代号)
A.碱石灰? B.生石灰? C.二氧化硅? D.五氧化二磷? E.烧碱
(3)按A接B接C;F接E接D接C,请在各虚线框内画上合适的装置图并注明所装试剂名称:
(4)在C中观察到大量白烟,同时产生一种气体单质,该反应的化学方程式为?,反应中氧化剂与还原剂的物质的量比为?。设计一个实验方案鉴定该固体是氯化铵(要求写出操作、现象及结论):?。
(5)从装置C的G处逸出的尾气可能含有污染环境的气体,如何处理:?
参考答案:(15分)(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O?(2分)(2)ABE?(3分)
Mn2++Cl2↑+2H2O?(2分)(2)ABE?(3分)
(3)(见右图)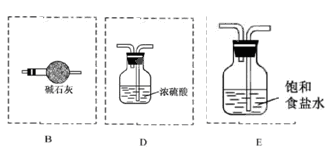 (3分)
(3分)
(4)3Cl2+8NH3=6NH4Cl+N2;3∶2 (各2分);取适量该白色固体与浓氢氧化钠溶液共热,产生能使湿润的红色石蕊试纸变蓝的无色气体;另取适量该白色固体,溶于水后加入硝酸银溶液,产生不溶于硝酸的白色沉淀?(2分)
(5)将尾气通过一倒置的漏斗通入盛有NaOH溶液的烧杯中(1分)
本题解析:(1)F装置是制备氯气的,浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式是MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)装置A是制备氨气的,氨水中存在电离平衡NH3·H2O NH4++OH-,碱石灰、生石灰和烧碱溶于水放出热量,且增大溶液中OH-的浓度,促使平衡向逆反应方向移动 进而放出氨气。二氧化硅不溶于水,五氧化二磷虽然溶于水时放热,但溶液显酸性,得不到氨气。因此正确的答案选A、B、E。
NH4++OH-,碱石灰、生石灰和烧碱溶于水放出热量,且增大溶液中OH-的浓度,促使平衡向逆反应方向移动 进而放出氨气。二氧化硅不溶于水,五氧化二磷虽然溶于水时放热,但溶液显酸性,得不到氨气。因此正确的答案选A、B、E。
(3)氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢应该选择饱和食盐水;水蒸气常用浓硫酸除去,因此正确的连接是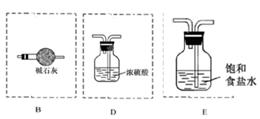 。
。
(4)在C中观察到大量白烟,同时产生一种气体单质,白烟应该是氯化铵,单质应该是氮气。这说明氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,反应的化学方程式是8NH3+3C12=6NH4C1+N2;根据方程式可知,氮元素的化合价从-3价升高到0价,氯元素的化合价从0价降低到-1价,所以根据电子的得失守恒可知,反应中氧化剂与还原剂的物质的量比为3∶2;氯化铵中含有氯离子和铵根离子,氯离子用硝酸酸化的硝酸银溶液检验;氨气用紫色石蕊试纸检验;检验方法为:将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取少量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+。
(5)氯气属于大气污染物,需要尾气处理,正确的的操作应该是将尾气通过一倒置的漏斗通入盛有NaOH溶液的烧杯中。
本题难度:一般