②
参考答案:(16分)(1)c?(2分)
(2)取少量溶液于试管中,滴加1—2滴酸性KMnO4溶液,振荡(2分)?溶液的紫红色褪去(2分)(或其它方法,但操作要与现象一致,否则只给操作分)
Fe3++Ag= Fe2++Ag+?(2分)
(3)4H++NO3- + 3Ag="NO" + 3Ag+ + 4H2O(2分)
实验步骤(不要求写具体操作过程)
预期现象和结论
①
若银镜消失,假设②成立。(2分)
若银镜不消失,假设②不成立。(2分)
②配制相同pH值的稀硝酸溶液,并将适量此溶液加入有银镜的试管内(2分)
本题解析:(1)ab中均会产生污染性气体,且原料利用率不高。选项c中产生的污染性气体最少,原料利用率高,答案选c。
(2)亚铁离子的检验常用酸性高锰酸钾溶液溶液,即)取少量溶液于试管中,滴加1—2滴酸性KMnO4溶液,振荡,溶液的紫红色褪去,即说明含有亚铁离子。铁离子氧化单质银的方程式为Fe3++Ag= Fe2++Ag+。
(3)在酸性条件下NO3-能氧化Ag,反应的方程式为4H++NO3- + 3Ag="NO" + 3Ag+ + 4H2O。由于乙同学放弃了检验NO3-在不同条件下的还原产物的方法,所以可以通过配制相同pH的硝酸溶液来和银反应,从而检验在此酸性条件下NO3-是不是能氧化Ag。
本题难度:一般
2、实验题 (14分)醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g·ml-1;
可能存在的副反应有:加热反应过程中反应混合物会呈现黄色甚至红棕色;醇在浓硫酸的存在下脱水生成烯和醚等。
(1)制备溴乙烷的需要用到蒸馏水、乙醇、溴化钠、浓硫酸,在烧瓶中加入这几种物质的顺序是?。
(2)小火加热,在烧瓶中发生的主要反应有①NaBr + H2SO4?= NaHSO4 + HBr
②?.;
(3)冷水的作用??;d试管中的现象?,
(4)用这种方法制取的溴乙烷中的含少量杂质Br2,欲除去溴代烷中的少量杂质Br2,下列供选试剂中最适合的是__________。
A.NaI溶液? B.NaOH溶液? C.Na2SO3溶液? D.KCl溶液?
(5)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象________________
(6)容器e中NaOH溶液的作用是__________________________________.
(7)制备操作中,加入的浓硫酸必需进行适当的稀释,其目的是_______。
A.减少副产物烯和醚的生成? B.减少Br2的生成
C.减少HBr的挥发?D.水是反应的催化剂?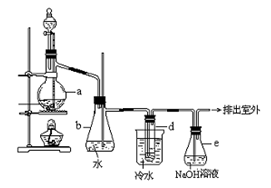
参考答案:每小题2分
(1)蒸馏水、浓硫酸、乙醇、溴化钠
(2)CH3CH2OH + HBr = CH3CH2Br +H2O
(3)冷却溴乙烷由气态转变为液态;分层,下层为油状液体(意思对即可得分)
(4)C
(5)直导管中有一段水柱(意思对即可得分)
(6)吸收HBr等气体,防止大气污染(意思对即可得分)
(7)ABC? (漏选1分,错选不得分)
本题解析:略
本题难度:简单
3、实验题 某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是_______________。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe3+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:
______________________。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)。

[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO3-都氧化了Ag。你是否同意丙同学的结论,并简述理由:__________________________。
参考答案:(1)ade
(2)Fe3++Ag= Fe2++Ag+
(3)将银镜在硝酸铜溶液中
(4)同意,4Fe3++6H2O+9Ag+3NO3-==4Fe(OH)3+9Ag++3NO↑
本题解析:
本题难度:困难
4、实验题 (1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L? H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用 ?来酸化KMnO4溶液,褪色所需时间tA? tB(填“>”、“=”或“<”).
②写出该反应的离子方程式 ? .
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol?L﹣1KMnO4溶液装入
? (填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因: ?。当 ?,证明达到滴定终点.
③计算:再重复上述操作2次,记录实验数据如下.
序号
| 滴定前读数(mL)
| 滴定后读数(mL)
| 1
| 0.00
| 20.10
| 2
| 1.00
| 20.90
| 3
| 0.00
| 21.10
|
则消耗KMnO4溶液的平均体积为 ? mL,已知H2C2O4的相对分子质量为90,则此样品的纯度为 ? 。
④误差分析:下列操作会导致测定结果偏高的是 ? 。
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视.
参考答案:(1)①硫酸,<;②5H2C2O4+2MnO4﹣+6H+=10CO2↑+2Mn2++8H2O。
(2)②酸式;反应中生成的锰离子具有催化作用,所以随后褪色会加快;当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色恰好变成紫红色且半分钟不变化;③ 20.00, 90.00% ;④ACD。
本题解析:(1)①高锰酸钾具有强氧化性,酸化高锰酸钾溶液应选用非还原性的酸,一般选稀硫酸;当其他条件不变时,温度越高反应速率越快,则褪色时间越短,褪色所需时间tA<tB;②酸性条件下,高锰酸根离子能氧化草酸生成二氧化碳,自身被还原生成锰离子,同时生成水,发生的离子反应方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O;(2)②酸性高锰酸钾溶液具有强氧化性,只能盛放在酸式滴定管中;在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。原因是高锰酸根离子被还原生成的锰离子有催化作用而导致反应速率加快,当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色恰好变成紫红色且半分钟不变化,证明达到终点。③分析表中数据知,第3组数据与前两组数据相差较大,应舍去,则消耗KMnO4溶液的平均体积20.00mL;设样品的纯度为x,
5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O
450g?2mol
5.0x×1/10g?(0.1×0.020)mol
解得x=90.00%;
④A.未用标准浓度的酸性KMnO4溶液润洗滴定管,会导致酸性高锰酸钾浓度偏小,需要高锰酸钾溶液体积偏大,测定结果偏高,正确;B.滴定前锥形瓶有少量水,对测定结果无影响,错误;C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失,高锰酸钾溶液体积偏大,测定结果偏高,正确;D.不小心将少量酸性KMnO4溶液滴在锥形瓶外,高锰酸钾溶液体积偏大,测定结果偏高,正确;E.观察读数时,滴定前仰视,滴定后俯视,高锰酸钾溶液体积偏小,测定结果偏低,错误;选ACD。
本题难度:一般
5、选择题 下列实验目的可以达到的是( )
A.电解熔融氯化镁制取金属镁
B.氯化铵溶液与石灰水共热制取氨气
C.浓硫酸与硫化钠共热制取硫化氢
D.用饱和碳酸钠溶液除去二氧化碳中的氯化氢
参考答案:A
本题解析:略
本题难度:一般
|