微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (16分)某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关利用Fe粉与稀HNO3制备Fe(NO3)3溶液的方法,最佳的是 。
a.把过量的铁粉与稀HNO3反应?
b.把铁粉与过量的稀HNO3反应
c.先把铁粉灼烧,再溶解于稀HNO3 中
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学为了验证假设1,取上述实验后的溶液,检验Fe2+。检验Fe2+的方法: ,甲同学观察到的实验现象为: ? ,甲同学检验出Fe2+,验证了假设1的成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2。请写出在酸性条件下NO3-氧化Ag的离子方程式: 。并帮乙同学完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生,乙同学放弃了检验NO3-在不同条件下的还原产物的方法)。
实验步骤(不要求写具体操作过程)
| 预期现象和结论
|
①测定上述实验用的Fe(NO3)3溶液的pH值
| ?
|
②
2、实验题 (14分)醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g·ml-1;
可能存在的副反应有:加热反应过程中反应混合物会呈现黄色甚至红棕色;醇在浓硫酸的存在下脱水生成烯和醚等。
(1)制备溴乙烷的需要用到蒸馏水、乙醇、溴化钠、浓硫酸,在烧瓶中加入这几种物质的顺序是?。
(2)小火加热,在烧瓶中发生的主要反应有①NaBr + H2SO4?= NaHSO4 + HBr
②?.;
(3)冷水的作用??;d试管中的现象?,
(4)用这种方法制取的溴乙烷中的含少量杂质Br2,欲除去溴代烷中的少量杂质Br2,下列供选试剂中最适合的是__________。
A.NaI溶液? B.NaOH溶液? C.Na2SO3溶液? D.KCl溶液?
(5)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象________________
(6)容器e中NaOH溶液的作用是__________________________________.
(7)制备操作中,加入的浓硫酸必需进行适当的稀释,其目的是_______。
A.减少副产物烯和醚的生成? B.减少Br2的生成
C.减少HBr的挥发?D.水是反应的催化剂?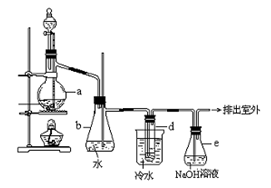
3、实验题 某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银, 制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是_______________。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe3+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:
______________________。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)。

[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO3-都氧化了Ag。你是否同意丙同学的结论,并简述理由:__________________________。
4、实验题 (1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L? H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用 ?来酸化KMnO4溶液,褪色所需时间tA? tB(填“>”、“=”或“<”).
②写出该反应的离子方程式 ? .
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol?L﹣1KMnO4溶液装入
? (填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因: ?。当 ?,证明达到滴定终点.
③计算:再重复上述操作2次,记录实验数据如下.
序号
| 滴定前读数(mL)
| 滴定后读数(mL)
| 1
| 0.00
| 20.10
| 2
| 1.00
| 20.90
| 3
| 0.00
| 21.10
|
则消耗KMnO4溶液的平均体积为 ? mL,已知H2C2O4的相对分子质量为90,则此样品的纯度为 ? 。
④误差分析:下列操作会导致测定结果偏高的是 ? 。
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视.
5、选择题 下列实验目的可以达到的是( )
A.电解熔融氯化镁制取金属镁
B.氯化铵溶液与石灰水共热制取氨气
C.浓硫酸与硫化钠共热制取硫化氢
D.用饱和碳酸钠溶液除去二氧化碳中的氯化氢
|