微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的,回收利用锂资源成为重要课题.某研究小组对某废旧锂离子电池正极材料(图中简称废料,成份为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如下:
已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.
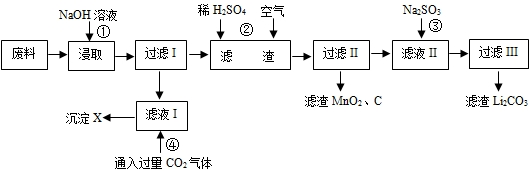
(1)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是______.
(2)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求______.
(3)写出反应④生成沉淀X的离子方程式:______.
(4)己知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的化学反应方程式:______.
(5)生成Li2CO3的化学反应方程式为______.已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应______.
参考答案:第一步就是铝溶解在氢氧化钠溶液中(注意LiMn2O4不溶于水)生成四羟基合铝酸钠,即滤液的主要成分,第二步就是四羟基合铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠的过程,第三步是LiMn2O4在酸性环境下能被空气中的氧气氧化发生的氧化还原反应,得到的滤液中有生成的硫酸锂,可能有过量的硫酸,最后一步加入碳酸钠之后所得的滤液主要成分为硫酸钠;
(1)粉碎废料,能增大废料与氢氧化钠溶液的接触面积,加快反应速率,故答案为:增大接触面积,加快反应速率.
(2)金属锂性质活泼,易与氧气、水发生反应,故答案为:隔绝空气和水分;
(3)四羟基合铝酸钠与过量二氧化碳反应得产物是Al(OH)3沉淀和碳酸氢钠,所以离子方程式为CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-.
(4)在酸性环境下,LiMn2O4能被空气中的氧气氧化,生成二氧化锰、硫酸锂和水,所以化学方程式为:4LiMn2O4+2H2SO4+O2=8MnO2+2Li2SO4+2H2O,
故答案为:4LiMn2O4+2H2SO4+O2=8MnO2+2Li2SO4+2H2O;
(5)硫酸锂和碳酸钠反应生成硫酸钠和碳酸锂沉淀,化学反应方程式为:Li2SO4+Na2CO3=Na2SO4+Li2CO3↓;Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应趁热过滤,
故答案为:Li2SO4+Na2CO3=Na2SO4+Li2CO3↓;趁热过滤.
本题解析:
本题难度:一般
2、实验题 为探究 Na、Mg、Al的金属活动性顺序,某课外小组同学进行了如下实验

(1)他们记录的实验现象有:①有剧烈反应,迅速生成大量的气体。 ② 浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红。 ③ 反应不剧烈,产生无色气体。 ④ 有气体产生,溶液变成红色。 与实验相对应的实验现象序号顺序为______________________。
(2)实验结论是___________________________。
参考答案:(1)②④①③
(2)金属活动性顺序为Na>Mg>Al
本题解析:
本题难度:一般
3、实验题 (9分)用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
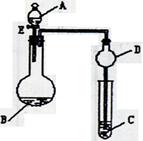
(1)图中D装置在实验中的作用是??。
(2)若 A为30%H2O2溶液,B为MnO2,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式为?。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现象是??;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3(碘酸为强酸),写出该反应的离子反应方程式?。
(4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是?,C中发生反应的离子方程式为?。
参考答案:(9分)⑴防倒吸(1分)
⑵2H2S + O2 ="=" 2S ↓+ 2 H2O? (2分)
⑶有气泡出现,同时溶液由无色变成蓝色(1分);6H2O +I2 +5Cl2===2IO3- + 10Cl- +12H+? (2分)
⑷有白色沉淀生成(1分)? Al3++3NH3.H2O ="==" Al(OH)3↓+ 3NH4+ (2分)
本题解析:略
本题难度:一般
4、实验题 (13分)有一固体样品,其中只含有Na2 CO3?10H2O和NaH
CO3?10H2O和NaH CO3.为了测定样品中Na2CO3的质量分数,请从下图中选用适当的实验装置,设计一个最简单的实验,测定固体样品中Na2CO3的质量分数。
CO3.为了测定样品中Na2CO3的质量分数,请从下图中选用适当的实验装置,设计一个最简单的实验,测定固体样品中Na2CO3的质量分数。

请填写下列各空:
(1)应选用的装置是(只写装置的代号,装置不重复)_________________,所选用装置的连接顺序是(填接口的字母):_______接_______,_______接_______,_______接_______ ……。
(2)装置⑥中应盛放的试剂是__________________,其作用是_____________________。
(3)选用 的装置连接好后,最后一个装置的作用是_______________________________。
的装置连接好后,最后一个装置的作用是_______________________________。
(4)写出吸收CO2的离子方程式____________________________________。
(5)停止加热时,正确的操作是____________________________________。
(6)取m g固体样品实验,经测定m g固体样品在加热时,完全分解,可得agCO2,则m g样品中所含。Na2CO3的质量分数为________________________________。(用含m、a的代数式表示)
参考答案:

本题解析:略
本题难度:一般
5、实验题 (10分)为了比较氯和碘单质氧化性的强弱,可先制取氯气,并将氯气通入碘化钾淀粉溶液中。下图是本实验所需的仪器和药品:图中A.B.C.D.E.F分别表示玻璃导管或仪器接口。

请回答下列问题:
(1)气体流向从左到右。实验前,上述各仪器装置的正确连接顺序是(填各接口的字母符号);D从E处插入烧瓶后,_____________接_____________,_____________接_____________。
(2)写出制备 的反应方程式:______?。
的反应方程式:______?。
某学生用含0.4molHCl的浓盐酸和足量MnO2反应制 得到的
得到的 总小于
总小于 (标况下)为什么?___________________?
(标况下)为什么?___________________?
(3)实验完成后,装置1中的溶液为_____________色,再向其中滴加足量 溶液颜色是否褪去?_____________(填“是”或“不是”),装置②中NaOH溶液的作用是:______? .
溶液颜色是否褪去?_____________(填“是”或“不是”),装置②中NaOH溶液的作用是:______? .
(4)工业上,可用 制备漂白粉,请写制备漂白粉的离子反应方程式:
制备漂白粉,请写制备漂白粉的离子反应方程式:
____________??。
参考答案:(10分)?
(1)(2分)F.B.A.C
(2)(2分)
浓盐酸随着反应的进行浓度变稀后,将不再反应, 浓盐酸具有挥发性。(1分)
(3)(3分)蓝?是?吸收剩余的Cl2
(4)(2分)
本题解析:略
本题难度:简单