微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 “化学是以实验为基础的科学”。在实验中感知化学知识是学好化学的关键。请针对以下实验回答问题:
(1)【实验一】室温下,将a?g?Ba(OH)2·8H2O粉末和a/2?g?NH4Cl粉末置于锥形瓶中,并将锥形瓶置于滴有几滴水的玻璃片上,迅速搅拌,然后用带有玻璃导管的单孔橡胶塞塞紧瓶口,如下图所示。

①该实验的现象是_________________。
②若将锥形瓶内物质加热产生的气体通入AlCl3溶液中,可观察到有白色沉淀生成,反应的离子方程式是________;分离出纯净的白色沉淀的主要操作有___________。
(2)【实验二】如下图所示,将适量的蔗糖放入小烧杯中,滴入几滴水,搅拌均匀。然后加入适量浓硫酸,迅速搅拌。反应放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀。

①蔗糖逐渐变黑,体现了浓硫酸的__________?性。
②湿润的品红试纸产生的现象是_________,产生该现象的物质是____________?,产生这一物质的化学方程式是___________,其中浓硫酸的作用是_____________。
④蘸有氢氧化钠溶液的棉花的作用是________________,发生反应的离子方程式是________________________。
(3)【实验三】如下图所示,将稀硝酸放入U型管中,把一端弯成螺旋状的Cu丝插到胶塞上。关闭分液漏斗活塞,塞好胶塞。

①反应一段时间后,可以看到a处液面下降,其他现象还有__________________。
②a处反应的离子方程式为_____________________?。
③检验a处产生气体的操作是_______________,现象和结论是________________?。
参考答案:(1)①锥形瓶壁变凉,玻璃片与锥形瓶粘在一起,有刺激性气味气体放出;②Al3++3NH3·H2O?=?Al(OH)3↓+3NH4+;过滤、洗涤、干燥
(2)①脱水;(2)湿润的品红试纸褪色;SO2;C+2H2SO4(浓) CO2↑+?2SO2↑+2H2O;强氧化剂;③吸收SO2,防止污染空气;?SO2?+2OH-=?SO32-+H2O
CO2↑+?2SO2↑+2H2O;强氧化剂;③吸收SO2,防止污染空气;?SO2?+2OH-=?SO32-+H2O
(3)①有无色气体生成,溶液变为蓝色;②3Cu?+?8H+?+?2NO3-?==?3Cu2+?+?2NO↑?+?4H2O;
③打开分液漏斗活塞;无色气体变为红棕色,说明该无色气体是NO。
本题解析:
本题难度:一般
2、实验题 影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响。
药品:Cu、Fe、Na和不同浓度的硫酸 (0. 5mol/L、2mol/L、18. 4mol/L);
装置如下图
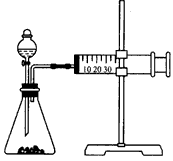
(1)用此装置进行定量实验,应选用的上述实验药品是__;
(2)应该测定的实验数据是___,
(3)此实验忽视了影响反应速率的其他因素是(假设金属颗粒是均匀的)___。
参考答案:(1) Fe、0.5mol/L硫酸、2mol/L硫酸
(2)测定一定时间产生气体的体积(或者测定生成一定体积的气体所需时间)
(3)温度对反应速率的影响
本题解析:
本题难度:一般
3、选择题 下列实验方案正确且能达到相应实验预期目的的是 (?)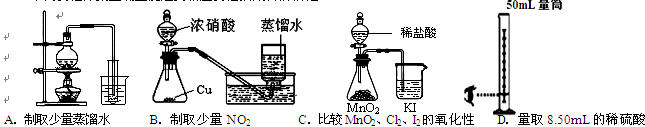
参考答案:A
本题解析:A、对天然水加热,使水变成水蒸气进入到成冷水的烧杯中,水蒸气遇冷,变成小水滴,即为蒸馏水,故A正确;
B、二氧化氮可以和水反应,不能用排水法来收集,故B错误;
C、二氧化锰和稀盐酸不反应,所以装置不能获得氯气,验证试验无法发生,故C错误;
D、对固体物质加热时,试管要略向下倾斜,防水倒流,炸裂试管,故D错误。
故选A。
点评:本题是一道化学实验方案的评价题,考查学生知识的梳理情况,可以根据教材知识来回答,难度不大。
本题难度:简单
4、实验题 应用化学反应需要研究化学反应的条件、限度和速率。
(1)773K、固定体积的容器中,反应CO(g)+2H2(g) CH3OH(g)过程中 能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入amol CO、2amol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
CH3OH(g)过程中 能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入amol CO、2amol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
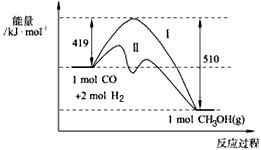
① 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为______________;
②在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可)______________、
______________;
③下列与催化剂有关的说法中,正确的是______________ (填字母序号)。
a.使用催化剂,使反应CO(g)+2H2(g) CH3OH(g) ΔH>-91 kJ·mol-1
CH3OH(g) ΔH>-91 kJ·mol-1
b.使用催化剂,能够提高反应物转化率
c.使用催化剂,不能改变反应的平衡常数K
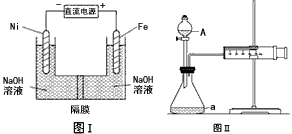
(2)高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如下图I所示。
①Fe电极作____________极(填“阴”或“阳”);
②Ni电极的电极反应式为:_________________。
(3)氧化还原反应中实际上包含氧化和还原两个过程。下面是HNO3发生的一个还原过程的反应式:
NO3-+4H++3e-→NO+2H2O
① KMnO4、Na2CO3、CuO、KI四种物质中的______________(填化学式)能使上述还原过程发生。
②欲用上图II装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定_________________________推算反应速率。
参考答案:(1)①10%;②增大CO浓度;适当降低温度(或:及时分离生成的CH3OH);③c
(2)①阳;②2H++2e-==H2(或2H2O+2e-==H2+2OH-)
(3)单位时间内收集的气体体积(或收集一定体积的气体所用的时间)
本题解析:
本题难度:困难
5、实验题 现有某金属硝酸盐化学式为M(NO3)2,为了探究其热分解产物,某化学小组开展探究性学习
【查阅资料】金属活泼性不同,其硝酸盐分解产物不同。如
2KNO3 2KNO2+O2↑
2KNO2+O2↑
Cu(NO3)2 2CuO+2NO2↑+O2↑,4AgNO3
2CuO+2NO2↑+O2↑,4AgNO3 4Ag+4NO2↑+O2↑
4Ag+4NO2↑+O2↑
【提出猜想】
猜想1?M(NO3)2 M(NO2)2+O2↑
M(NO2)2+O2↑
猜想2?2M(NO3)2 2MO+4NO2↑+O2↑
2MO+4NO2↑+O2↑
猜想3 __________________
【设计实验】为了探究上述猜想,设计如下实验装置
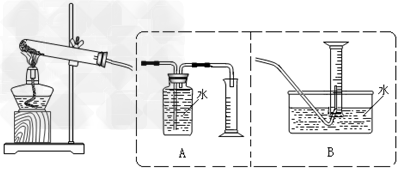
实验步骤:①连接仪器;②检查装置气密性;③取一定量样品装于大试管,并重新连接好仪器;④加热;⑤……
(1)写出猜想3的化学方程式________________;
(2)测定气体体积应选择?______?(填A或B);不选另一个装置的理由是__________________________
(3)实验收集到一定量气体,为了检验收集气体的成分,其操作方法是_____________________;
(4)在实验后的水里加入适量碳酸氢钠粉末,溶液中产生大量气体,说明?_______?正确(填:猜想1、猜想2或猜想3)
(5)该小组测得两组数据:
①实验前样品质量为Wg,收集到气体体积为V?L;
②实验前样品质量为Wg,完全分解后测得固体产物质量为m?g;
请你选择其中一组数据,计算M的相对原子质量为?_________________?
参考答案:(1)M (NO3)2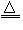 M+2NO2↑+O2↑
M+2NO2↑+O2↑
(2 )B;装置A不应长导管进气,这样不能排水集气;导水管口应伸入量筒中下部,以便读数前调平液面
)B;装置A不应长导管进气,这样不能排水集气;导水管口应伸入量筒中下部,以便读数前调平液面
(3)用玻璃片在水槽里盖好量筒口,用食指摁紧玻璃片,将量筒从水槽里拿出来,正放在实验台上,移开玻璃片,用带火星木条接近量筒口,若木条燃烧更旺,说明收集到的气体是氧气
(4)猜想3
(5)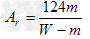
本题解析:
本题难度:一般