微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 6g Mg、Cu合金与一定量的硝酸恰好完全反应,收集到标准状况下VL NO和NO2的混合气体。向反应后的溶液中加入足量NaOH溶液,得到沉淀12.12g。则V的值可能是
A.2.688
B.4.48
C.8.064
D.8.96
参考答案:B
本题解析:Mg、Cu都是+2价的金属,失去的电子数与硝酸得到的电子数相等。Mg则变为Mg(OH)2沉淀,Cu变为Cu(OH)2沉淀。因此变为沉淀的OH-的物质的量与电子转移的物质的量相等。沉淀增加的质量即为OH-的质量。n(OH-)=(12.12-6)g÷17g/mol=0.36mol。n(e-)= n(OH-)=0.36mol。若气体完全为NO,则根据电子守恒可的n(NO)="0.36mol÷3×22.4L/mol=2.688L;" 若气体完全为NO2,则根据电子守恒可的n(NO2)=0.36mol÷1×22.4L/mol=8.064L.但实际上产生的气体既有NO也有NO2。所以放出气体的体积应该在2.688L~8.064L之间。因此选项为B。
本题难度:一般
2、计算题 取2.5克KClO3粉末置于冰水冷却的锥形瓶中,加入5.0克研细的I2,再注入3cm3水,在45分钟内不断振荡,分批加入9~10cm3浓HCl,直到I2完全消失为止(整个反应过程保持在40℃以下)。将锥形瓶置于冰水中冷却,得到橙黄色的晶体A。
将少量A置于室温下的干燥的试管中,发现A有升华现象,用湿润的KI-淀粉试纸在管口检测,试纸变蓝.接着把试管置于热水浴中,有黄绿色的气体生成,管内的固体逐渐变成红棕色液体。
将少量A分别和KI,Na2S2O3,H2S等溶液反应,均首先生成I2。
酸性的KMnO4可将A氧化,得到的反应产物是无色的溶液。
(1)写出A的化学式;写出上述制备A的配平的化学方程式。
(2)写出A受热分解的化学方程式。
(3)写出A和KI反应的化学方程式。
附:原子量 K 39.10;Cl 35.45;I 126.9;O 16.00
参考答案:(1)ICl3,KClO3十I2+6HCl=2ICl3+KCl+3H2O
(2)ICl3=ICl+Cl2
(3)ICl3+3I-=2I2+3Cl
本题解析:M(KClO3)=122.55g·mol-1,M(I2)=253.8g·mol-1
n(KClO3)=0.0204mol,n(I2)=0.0197mol,n(KClO3)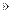 n(I2)。橙黄色的晶体A
n(I2)。橙黄色的晶体A
可以升华,A为分子晶体,A的化学式应为ICln。
生成A的反应物为:KClO3、I2、浓HCl,生成物为ICln和KCl。在ICln中I和Cl的氧化数分别为+n、-1。KClO3中Cl的氧化数降6,I2中I的氧化数升高n,根据氧化数的变化数相等,得:2n=6,n=3。A的化学式是ICl3。
(1)ICl3,KClO3十I2+6HCl=2ICl3+KCl+3H2O
(2)ICl3=ICl+Cl2
(3)ICl3+3I-=2I2+3Cl
本题难度:一般
3、选择题 2.8 g Fe全部溶于一定浓度、200 mL的HNO3溶液中,得到标准状况下的气体1.12 L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是( )。
A.反应后溶液中c(NO3-)=0.85 mol·L-1
B.反应后的溶液最多还能溶解1.82 g Fe
C.反应前HNO3溶液的浓度为1.0 mol·L-1
D.1.12 L气体是NO、NO2的混合气体
参考答案:AB
本题解析:据题意,硝酸过量:0.2 L×0.1 mol·L-1=0.02 mol,反应生成Fe3+:2.8 g÷56 g·mol-1=0.05 mol,A项中据反应后溶液中的电荷守恒,得c(NO3-)=(0.05 mol×3+0.02 mol×1)÷0.2 L=0.85 mol·L-1,该项正确;B项中反应后的溶液还能与铁发生反应的离子方程式为:
3Fe + 8H+ + 2NO3-=3Fe2++2NO↑+4H2O
3 ?8 2
0.02 mol×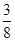 0.02 mol ? 0.17 mol(过量)
0.02 mol ? 0.17 mol(过量)
2Fe3+ + Fe = 3Fe2+
0.05 mol 0.025 mol
则最多能溶解铁:(0.02 mol×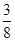 +0.025 mol)×56 g·mol-1=1.82 g,故该项正确;C项中据氮原子守恒,反应前HNO3溶液的浓度为(0.17 mol+1.12 L÷22.4 L·mol-1)÷0.2 L=1.1 mol·L-1,故该项错误;D项中反应前硝酸的溶液为稀溶液(c(HNO3)=1.1 mol·L-1),1.12 L气体应是NO气体,故该项错误。
+0.025 mol)×56 g·mol-1=1.82 g,故该项正确;C项中据氮原子守恒,反应前HNO3溶液的浓度为(0.17 mol+1.12 L÷22.4 L·mol-1)÷0.2 L=1.1 mol·L-1,故该项错误;D项中反应前硝酸的溶液为稀溶液(c(HNO3)=1.1 mol·L-1),1.12 L气体应是NO气体,故该项错误。
本题难度:一般
4、简答题 焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈.发生的反应体系中共有六种物质:NH4C1、FeC13、N2、Fe2O3、Fe和X.
(1)根据题意,可判断出X是______(写化学式).
(2)写出并配平该反应的化学方程式:______;
(3)当转移的电子总数为a个时,氮气物质的量变化了bmol,阿伏加德罗数常数为(用含a、b的代数式表示)______.
(4)反应中被氧化产生了11.2L(标准状况)的气体时,被还原的物质的质量为______.
参考答案:(1)根据焊药为氯化铵,其作用是消除焊接处的铁锈可知反应物为NH4C1、Fe2O3,
则该反应得生成物为FeC13、N2、Fe和X,
根据元素守恒可知X中含有H、O元素,则X为H2O,
故答案为:H2O;
(2)由反应物和生成物可知,
NH4C1+Fe2O3→Fe+FeC13+N2↑+H2O,
该反应Fe元素的化合价由+3价降低为0,N元素的化合价由-3价升高到0,
根据电子守恒可知,得电子数=失去电子数=18e-,则
6NH4C1+Fe2O3→6Fe+FeC13+3N2↑+H2O,
再质量守恒定律可知,配平的化学反应为6NH4C1+4Fe2O3═6Fe+2FeC13+3N2↑+12H2O,
故答案为:6NH4C1+4Fe2O3═6Fe+2FeC13+3N2↑+12H2O;
(3)由6NH4C1+4Fe2O3═6Fe+2FeC13+3N2↑+12H2O可知,生成3molN2时转移的电子数为18mole-,
设阿伏加德罗数常数为x,由转移的电子总数为a个时,氮气物质的量变化了bmol,
则bax=3mol18mol,解得x=a6b,故答案为:a6b;
(4)11.2L(标准状况)的气体,其物质的量为11.2L22.4L/mol=0.5mol,
由6NH4C1+4Fe2O3═6Fe+2FeC13+3N2↑+12H2O可知,
气体与起氧化剂作用的氧化铁得关系为,33N2↑~3Fe2O3,
则被还原的物质的质量为0.5mol×160g/mol=80g,
故答案为:80.
本题解析:
本题难度:一般
5、填空题 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
 SiO2 +
SiO2 + C+
C+ N2
N2
 Si3N4+
Si3N4+ CO
CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是___________,其还原产物是___________;
(3)该反应的平衡常数表达式为K=___________;
(4)若知上述反应升高温度,其平衡常数值减小,则该反应的反应热ΔH______零(填“大于”、“小于”或“等于”);
参考答案:(1) (2)N2;Si3N4
(2)N2;Si3N4
(3)c6(CO)/c2(N2)
(4)小于
本题解析:
本题难度:一般