微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 原子晶体干冰具有类似SiO2的晶体结构,下列有关它的推断中,错误的是
A.它可作耐磨材料
B.它不可用作致冷剂
C.晶体中每个碳原子形成2个碳氧双键
D.晶体中碳、氧原子个数之比为1:2
参考答案:C
本题解析:A、原子晶体的熔沸点高,硬度大,所以它可作耐磨材料,A正确;B、原子晶体的熔沸点高,它不可用作致冷剂,B正确;C、在二氧化硅晶体,每个硅原子形成4个Si-O单键,因此在CO2原子晶体中,每个碳原子形成4个碳氧单键,C不正确;D、根据化学式可知,晶体中碳、氧原子个数之比为1:2,D正确,答案选C。
本题难度:一般
2、选择题 下列说法正确的是( )
A.白磷是正四面体分子,键角是109°28′,1摩尔白磷含共价键6NA个
B.臭氧是直线型分子,等质量的臭氧和氧气所含的氧原子数相同
C.S8是分子晶体,8个硫原子形成环状结构,摩尔质量为256g
D.石墨晶体呈层状结构,每个碳原子只有3个价电子形成共价键
参考答案:D
本题解析:
本题难度:简单
3、选择题
A.KCl、H2S
B.H2、I2
C.NH4Cl、NaCl
D.CO2、SiO2
参考答案:C
本题解析:A、D项晶体类型不同,B项晶体类型和化学键类型均相同,C项二种都是离子晶体,但NH4Cl中有离子键和共价键,NaCl中只有离子键。
本题难度:一般
4、填空题 (8分)已知A、B、C、D和E都是元素 周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周
周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周 期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成
期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成 离子化合物其晶胞结构如图。
离子化合物其晶胞结构如图。
 请回答:
请回答:

 (1)
(1) 画出A的原子结构示意图?;
画出A的原子结构示意图?;
(2) E的+2价离子的电子排布式为?
E的+2价离子的电子排布式为? ?;
?;
(3) 写出C的单质与水反应的离子方程式?;
写出C的单质与水反应的离子方程式?;
(4)如图所示,D跟B形成的离子化合物的化学式为?;鉴 别该离子化合物是否为晶体,最可靠的科学方法是?,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相
别该离子化合物是否为晶体,最可靠的科学方法是?,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相 对原子质量分别为b、c,则晶胞的体积是?cm3(只要求列出算式)。
对原子质量分别为b、c,则晶胞的体积是?cm3(只要求列出算式)。
参考答案:(8分)
(1)略(1分)
(2)1s22s22p63s23p63d6(1分)
(3)Cl2+H2O=H+ +Cl-+HClO(2分)
(4)CaF2?X射线衍射法(各1分)?(8b+4c)/a NA(2分)
本题解析:略
本题难度:一般
5、填空题 (1)水在不同的温度和压强条件下可以形成11种不同结构的晶体,密度从比水轻的0.92 g·cm-3到约为水的一倍半。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰-Ⅶ的晶体结构为一个如下图所示的立方晶胞,每个水分子可与周围____________个水分子以氢键结合,晶体中,1 mol水可形成________ mol氢键。
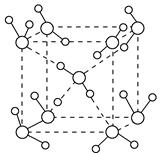
(2)已知下列元素的电负性数据:H为2.1,O为3.5,F为4.0。OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F—O键中共用电子对偏向F而产生的极性;②从电负性上看,___________________________。
参考答案:(1)4 2
(2)氧与氢的电负性差大于氧与氟的电负性差
本题解析:(1)观察图示的立方晶胞的中心水分子可知,该水分子与周围4个水分子以氢键结合;每2个水分子间形成的1个氢键,每个水分子只分得一半,故晶体中1 mol水可形成4 mol×0.5=2 mol氢键。(2)根据题中所给出的元素的电负性数据:H为2.1,O为3.5,F为4.0,氧与氢的电负性差(1.4)大于氧与氟的电负性差(0.5),因此,虽然OF2与水的立体结构相似,但水分子的极性比OF2强得多。
本题难度:一般