微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法与盐类水解无关的是(?)
A.Na2CO3、NaHCO3被视作“碱”用于面食制作
B.NaHSO4溶液显酸性
C.铝盐可用作净水剂
D.TiCl4溶液经蒸干、焙烧制得TiO2
参考答案:B
本题解析:A? CO32-、HCO3-水解显碱性
B ?NaHSO4是强酸的酸式盐,全部电离,显酸性,不是水解导致
C? Al3+水解会得到Al(OH)3胶体可做净水剂
D ?Ti4+水解得Ti(OH)4和HCl,HCl挥发,使水解平衡右移,得到Ti(OH)4,在焙烧得TiO2
所以与水解无关的是B
本题难度:简单
2、选择题 现有0.4 mol·L-1HA溶液和0.2 mol·L-1NaOH溶液等体积混合组成的混合溶液。下列有关推断正确的是(? )
A.若该溶液中HA的电离能力大于A-的水解能力,则有c(Na+)>c(A-)> c(HA)> c(H+)>c(OH-)
B.若该溶液中A-的水解能力大于HA的电离能力,则有c(A-)>c(HA)>c(Na+)> c(OH-)>c(H+)
C.无论该溶液呈酸性还是碱性,都有c(Na+)+c(H+)=c(A-)+c(OH-)
D.无论该溶液呈酸性还是碱性,都有c(Na+)=c(A-)+c(HA)
参考答案:C
本题解析:依题意知,混合溶液中c(HA)="0.1" mol·L-1,c(NaA)="0.1" mol·L-1。A项,若HA的电离能力大于A-的水解能力:HA H++A-(主要),A-+H2O
H++A-(主要),A-+H2O HA+OH-(次要),则溶液呈酸性:c(H+)>c(OH-)。由电荷守恒知,c(H+)+c(Na+)=c(OH-)+c(A-),c(Na+)<c(A-),由于弱电解质的电离程度一般很小,故c(A-)>c(Na+)>c(HA)> c(H+)>c(OH-),A项错误;B项,HA
HA+OH-(次要),则溶液呈酸性:c(H+)>c(OH-)。由电荷守恒知,c(H+)+c(Na+)=c(OH-)+c(A-),c(Na+)<c(A-),由于弱电解质的电离程度一般很小,故c(A-)>c(Na+)>c(HA)> c(H+)>c(OH-),A项错误;B项,HA H++A-(次要),A-+H2O
H++A-(次要),A-+H2O HA+OH-(主要),溶液呈碱性:c(OH-)>c(H+),根据电荷守恒知,c(Na+)>c(A-),由于弱酸根离子的水解程度一般都很小,所以,有c(HA)>c(Na+)>c(A-)>c(OH-)>c(H+),B项错误;C项,由溶液组成知,溶液中只存在H+、Na+、A-、OH-四种离子,由电荷守恒知,c(Na+)+c(H+)=c(OH-)+c(A-),C项正确;D项,根据物料守恒:c(HA)+c(A-)=2c(Na+),D项错误。
HA+OH-(主要),溶液呈碱性:c(OH-)>c(H+),根据电荷守恒知,c(Na+)>c(A-),由于弱酸根离子的水解程度一般都很小,所以,有c(HA)>c(Na+)>c(A-)>c(OH-)>c(H+),B项错误;C项,由溶液组成知,溶液中只存在H+、Na+、A-、OH-四种离子,由电荷守恒知,c(Na+)+c(H+)=c(OH-)+c(A-),C项正确;D项,根据物料守恒:c(HA)+c(A-)=2c(Na+),D项错误。
本题难度:一般
3、选择题 施用碳酸氢铵、氯化铵等铵态氮肥能够促进农作物生长,但是铵态氮肥不能与碱性肥料如草木灰混合使用,其原因是铵态氮肥
A.易溶于水
B.能与碱反应
C.受热易分解
D.在水中易发生电离
参考答案:B
本题解析:原理反应为:NH4++OH-=NH3.H2O;
本题难度:简单
4、选择题 盐的水解程度大小可以用“水解度”来表示。关于NaA型盐的水解度,就是已水解的盐的物质的量占原来盐总物质的量的百分数。若测得2L1mol·L-1的强碱弱酸盐NaA溶液的pH为10,则A-离子(A-表示一元酸根离子)的水解度是
A.0.01%
B.0.1%
C.0.2%
D.1%
参考答案:A
本题解析:pH=10,则溶液中OH-的浓度是0.0001mol/L,所以A-的水解程度是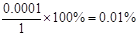 ,答案选B。
,答案选B。
点评:本题主要考查学生获取信息的能力,通过信息进行解题。
本题难度:一般
5、选择题 下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污
B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深
D.明矾净水
参考答案:B
本题解析:略
本题难度:简单