微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2 (g)=2Cu2O(s)+2SO2(g)?△H=-768.2kJ·mol-1,
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)?△H=+116.0kJ·mol-1,
①热化学方程式:Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=?kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作?极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4。
①该反应还原剂是?(写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为?。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图所示。

①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为?。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为?(任写一个)。
参考答案:
(1)①-217.4;②阳;
(2)①H3PO2; ②1mol;
(3)①C(CuCl2)>C(CuCl-)>C(CuCl3)②CuCl-+Ag+=AgCl+Cu2+(CuCl2+Ag+=CuCl++AgCl; CuCl2+Ag+=Cu2++2AgCl)
本题解析:①根据盖斯定律,可通过已知方程式1与方程2相加后除以3可得目标热化学方程式:Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H=-217.4kJ·mol-1。②粗铜精炼是电解原理的运用,只有粗铜做阳极时,纯铜做阴极才能提纯。(2)在反应:4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4?中,①该反应还原剂是化合价升高的物质,即为H3PO2。②该反应每转移3mol电子,生成CuH的物质的量为1mol。(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如右图所示。①当c(Cl-)=9mol·L-1时,过这一点在图像中做垂线平行于纵轴,得出大小关系如答案所示。②根据图像可以看出当在c(Cl-)=1mol·L-1时存在含有氯离子的物质有氯化铜和其阴、阳离子,故反应方程式可以有溶:②CuCl-+Ag+=AgCl+Cu2+(CuCl2+Ag+=CuCl++AgCl; CuCl2+Ag+=Cu2++2AgCl)
本题难度:困难
2、选择题 下列反应不属于四种基本反应类型,但属于氧化还原反应的是
A.CuO+CO Cu+CO
Cu+CO
B.2NaHCO
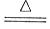 Na
Na CO
CO +H
+H O+CO
O+CO
C.2H +O
+O
 2H
2H O
O
D.Zn+H SO
SO =ZnSO
=ZnSO + H
+ H
参考答案:A
本题解析:B是分解反应,C是化合反应,D是置换反应,答案选A。
点评:判断化学反应类型的关键是掌握概念的含义,特别是概念的内涵和外延等。本题基础性强,难易适中。
本题难度:一般
3、简答题 氨气和氧气在催化剂存在下的反应方程式为4NH3+5O2
4NO+6H2O完成下列计算:
(1)生成2mol NO消耗氧气的体积为______L(标准状况).
(2)10mol?NH3和10mol O2反应生成8mol NO,过量的氨溶于产物水中成为氨水,计算该氨水中氨的质量分数.
(3)经研究发现,氨氧化生成NO的同时也生成氮气:4NH3+3O2→2N2+6H2O若2mol?NH3和2mol O2恰好完全反应,计算产物气体中NO的物质的量.
参考答案:(1)令参加参加反应的氧气的物质的量为amol,则:
4NH3+5O2=4NO+6H2O
? 5? 4
?amol ?2mol
所以5:4=amol:2mol,解得a=2.5mol,
故参加反应氧气的体积为2.5mol×22.4L/mol=56L,
故答案为:56;?
(2)令参加反应的氨气为nmol、生成的水为bmol,则:
4NH3+5O2=4NO+6H2O
4? 4? 6
nmol? 8mol? bmol
所以4:4=nmol:8mol,解得n=8,
4:6=8mol:bmol,解得b=12mol,
故属于氨气为10mol-8mol=2mol,
所得氨水的质量分数为2mol×17g/mol2mol×17g/mol+12mol×18g/mol×100%=13.6%
答:所得氨水质量分数为13.6%;
(3)令气体中NO、N2的物质的量分别为xmol、ymol,
根据氮原子守恒有:x+2y=2
根据电子转移守恒有:5x+6y=8
联立解得:x=1,y=0.5,
答:产物气体中NO的物质的量为1mol.
本题解析:
本题难度:一般
4、简答题 将19.2g铜加入到足量的稀硝酸溶液中,反应完全,反应后溶液的体积为500mL.计算:
(1)产生的气体在标准状况下的体积;
(2)反应后溶液中Cu2+的物质的量浓度.
参考答案:(1)19.2g铜的物质的量=19.2g64g/mol=0.3mol,则:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3? 2
0.3mol?n(NO)
故n(NO)=0.2mol,所以V(NO)=0.2mol×22.4L/mol=4.48L,
答:生成NO的体积为4.48L.
(2)根据铜原子守恒可知n(Cu2+)=n(Cu)=0.3mol,
故c(Cu2+)=0.3mol0.5L=0.6mol/L,
答:反应后溶液中Cu2+的物质的量浓度为0.6mol/L.
本题解析:
本题难度:一般
5、选择题 0.2 molX2O72-与600mL1 mol/L Na2SO3溶液恰好完全反应,则反应后X的价态变为
A.0
B.+3
C.+2
D.+4