微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)按下图所示装置进行实验,并回答下列问题:

(1)判断装置的名称:A池为 ,B池为 ;
(2)锌极为 极,铜极上的电极反应式为 ,
石墨棒C1为 极,电极反应式为 ,
石墨棒C2附近产生的现象为 ;
(3)当C2极析出气体224mL(标准状况),锌的质量变化为 ; g(“增加”或“减少”)。
参考答案:(1)原电池,电解池 (2)负极,Cu2+ + 2 e— ="Cu" ,阳极,2Cl——2e— = Cl2↑,有无色气泡产生附近溶液变红色,(3)减少 0.65
本题解析:(1)根据装置特点,A池存在自发的氧化还原反应,则A池为原电池,B池为电解池;
(2)锌比铜活泼,锌极为负极,铜极为正极,铜极上的电极反应为Cu2+ + 2 e— =Cu,石墨棒C1与正极相连,为阳极,电极反应式为2Cl——2e— = Cl2↑,B池为电解氯化钾溶液,石墨棒C2为阴极,在阴极生成氢气和氢氧化钾,则附近产生的现象为有无色气泡产生附近溶液变红色;
(3)根据电子守恒,阴极:2H++2e-=H2↑负极:Zn-2e-=Zn2+当C2极析出气体224mL(标准状况),气体的物质的量为0.01mol,转移电子0.02mol,则锌的质量减少0.65g。
考点:考查原电池、电解池的工作原理。
本题难度:一般
2、选择题 如图所示,下列叙述正确的是
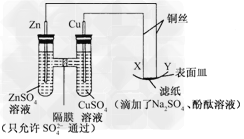
[? ]
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红
参考答案:A
本题解析:
本题难度:一般
3、选择题 1L?1mol?L-1?AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16g时,下列判断中不正确的是( )
A.溶液的浓度仍为?1?mol?L-1
B.阳极上产生112?mL?(标准状况下)?O2
C.转移的电子数约为1.204×1022个
D.反应中有0.02?mol金属被氧化
参考答案:Ag作阳极,则阳极反应式为Ag-e-=Ag+,AgNO3溶液为电解质溶液,则阴极发生Ag++e-=Ag,
A.由上述分析可知,该过程为电镀,电解质溶液的浓度不变,故A正确;
B.阳极反应式为Ag-e-=Ag+,不会生成氧气,故B错误;
C.n(Ag)=2.16g108g/mol=0.02mol,则转移的电子数约为0.02×6.02×1023=1.204×1022个,故C正确;
D.由n(Ag)=0.02mol,阳极反应式为Ag-e-=Ag+,阴极发生Ag++e-=Ag,则反应中有0.02?mol金属被氧化,故D正确;
故选B.
本题解析:
本题难度:简单
4、选择题 下列说法正确的是 (?)
A.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O+ 4e- ="=" 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜
D.钢铁发生电化腐蚀的正极反应式:Fe-2e- ="=" Fe2+
参考答案:A
本题解析:A.电解饱和食盐水时,由于阴离子的放电能力:Cl-> OH-,所以在阳极的电极反应式为:2Cl- ?-2e-= Cl2 ↑。正确。B.氢氧燃料电池的正极反应式:O2 + 2H2O+ 4e- ="=" 4OH-。错误。C.粗铜精炼时,与电源正极相连的是粗铜,与电源的负极相连的是纯铜。错误。D.钢铁发生电化腐蚀的负极反应式:Fe-2e- =Fe2+。错误。
本题难度:一般
5、选择题 用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH同时得到某种副产物,其原理如图所示(电极材料为石墨)。下列说法不正确的是
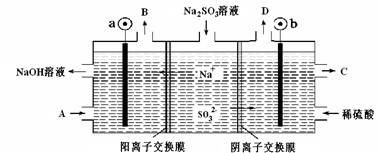
A.b电极上的主反应是 SO32--2e-+H2O===SO42-+2H+
B.若D是混合气体,则可能含有SO2、O2等成分
C.a 电极发生还原反应,当有1mol Na+通过阳离子交换膜时,a极生成11.2L气体
D.A溶液是稀NaOH溶液,作用是增强溶液的导电性;C是较浓的硫酸溶液