| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《离子方程式的书写及正误判断》试题强化练习(2017年最新版)(二)
参考答案:D 本题解析:A.向KHSO4溶液中滴人Ba(OH)2溶液使pH=7,中性溶液,H+与OH-恰好反应,SO42-+ 2H+ + Ba2+ + 2OH-= BaSO4↓ + 2H2O,A正确 ;B.明矾水解的离子方程式: Al3++3 H2O 本题难度:一般 2、填空题 (10分)某海域海水一些化学成分如下表
某化学小组同学欲在实验制备MgCl2,并提取Zn。设计流程如下: 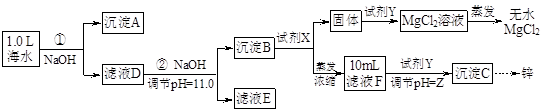 [假设①②过程溶液体积不变,忽略分离过程的损失] (1)25℃时测得海水的pH为8.0,其原因是(写离子方程式) 。 (2)下图为溶液pH与对应的Zn2+、[Zn(OH)4]2-物质的量浓度的对数坐标图。 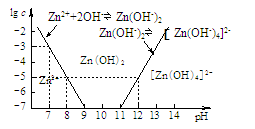 请结合图中数据回答: 试剂X的化学式为 ;由滤液F到沉淀C过程(一般认为离子浓度低于10-5mol/L就是沉淀完全),则调节的pH的范围为 。 (3)同学们发现,把MgCl2溶液蒸发、灼烧所得的白色固体难溶解于水,于是认为其主要成分是MgO。你认为 (填“正确”、“不正确”),原因是(用化学方程式表示) 、 。 (4)由图中c(Zn2+)计算Zn(OH)2的溶度积Ksp= 。 参考答案:(1)HCO3-+H2O?H2CO3+OH- 本题解析:(1)海水中的成分是弱酸的酸式酸根离子,水解使溶液呈碱性:HCO3-+H2O?H2CO3+OH-;(2)海水在①加入NaOH使转化为碳酸根离子与钙离子反应产生沉淀A碳酸钙,滤液D继续加入NaOH至PH=11.0,产生沉淀B,成分为氢氧化锌和氢氧化镁,沉淀B继续加入NaOH将氢氧化锌溶解,而氢氧化镁不溶,从而分离,根据浓度对数一PH图表可知:由滤液F到沉淀C过程,将锌离子转化为氢氧化锌沉淀的PH范围为9-11,一般认为离子浓度低于10-5mol/L就是沉淀完全,由c(Zn2+)=10-5mol/L,lgc=-5,PH=8,c([ Zn(OH-)4]2-)=10-5mol/L,lgc=-5,PH=12,故应调节的pH的范围为8-12;(3)MgCl2是强酸弱碱盐,水解MgCl2+2H2O?Mg(OH)2+2HCl,加热使水解程度增大而产生氢氧化镁,同时产生的盐酸易挥发使平衡正向移动,最终产生的氢氧化镁沉淀灼烧分解产生氧化镁和水,涉及的反应为:MgCl2+2H2O 本题难度:困难 3、选择题 下列指定反应的离子方程式正确的是 |
参考答案:C
本题解析:A、金属钠与水反应应为:2Na+2H2O=2Na++2OH-+H2↑,错误;B、用醋酸除去水垢中的碳酸钙应为:CaCO3+2CH3COOH=Ca2++2CH3COO—+H2O+CO2↑,错误;C、硫酸氢钠溶液与氢氧化钡溶液恰好反应呈中性:2H++SO42-+Ba2++2OH-= 2H2O+BaSO4↓,正确;D、电解饱和MgCl2溶液应为:Mg2++2Cl-+2H2O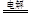 2Mg(OH)2↓+H2↑+Cl2↑,错误。
2Mg(OH)2↓+H2↑+Cl2↑,错误。
考点:考查离子方程式正误判断。
本题难度:一般
4、填空题 (8分)有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成;
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生;
③取少量②的溶液滴入AgNO3溶液,有白色沉淀生成。
(1)根据上述实验现象,判断原白色粉末中肯定含有______________,可能含有____________。
(2)写出有关反应的离子方程式:______________________________________ ;
_______。
参考答案:(1)CaCl2、K2CO3; Ba(NO3)2
(2)Ca2+ + CO32- = CaCO3↓;CaCO3 +2H+ = Ca2+ + CO2↑ + H2O
本题解析:①将部分粉末加入水中,振荡,有白色沉淀生成,说明含有能生成白色沉淀的物质,白色沉淀可以是碳酸钡或碳酸钙;②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生;证明沉淀一定是碳酸钙或碳酸钡沉淀;③取少量②的溶液商入AgNO3溶液,有白色沉淀生成,证明含有氯离子,混合物中一定含有氯化钙,说明一定含有K2CO3、CaCl2;可能含有Ba(NO3)2;(1)根据上述实验现象,判断白色粉末中肯定含有K2CO3、CaCl2;可能含有Ba(NO3)2,(2)有关反应的离子方程式为:Ca2++CO32-=CaCO3↓;CaCO3+2H+=Ca2++CO2↑+H2O;Ag++Cl-=AgCl↓。
考点:考查物质的检验。
本题难度:一般
5、选择题 下列离子方程式书写正确的是
A.Na2S溶液水解:S2-+H2O=HS-+OH-
B.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C.向酸性氯化亚铁溶液中加入过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O
D.铜与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
参考答案:C
本题解析:
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《原电池原理.. | |