微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法不正确的是(? )
A.活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同
B.同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积不相等
C.将SO2气体通入BaCl2溶液中至饱和,未见沉淀生成,继续通入NO2则有沉淀生成
D.将足量Cl2通入NaBr、NaI的混合溶液中,反应后将溶液蒸干并充分灼烧,剩余的固体物质成分为NaCl
参考答案:B
本题解析:活性炭、SO2、Na2O2能使品红溶液褪色的原因分别是吸附作用、化合漂白和氧化漂白,A正确;根据反应Fe+H2SO4=FeSO4+H2↑可得,铁粉与足量稀硫酸反应时,1 mol Fe完全反应产生1 mol H2,根据反应Fe+4HNO3=Fe(NO3)3+NO↑+2H2O可得,1 mol Fe完全反应产生1 mol NO,二者产生气体的体积相等,B错;C选项,NO2与水反应生成HNO3,HNO3能将SO2氧化为H2SO4,H2SO4与BaCl2反应生成BaSO4沉淀,C正确;Cl2通入NaBr、NaI的混合溶液中生成NaCl、Br2、I2,蒸干并充分灼烧时,Br2挥发、I2升华,剩余NaCl,D正确
本题难度:一般
2、计算题 (8分)在加热条件下,用MnO2与足量浓盐酸反 应,制得氯气0.56L(标准状况)。问:
应,制得氯气0.56L(标准状况)。问:
(1)理论上 91ExaM.org需要消耗MnO2多少克?
(2)被氧化的HCl的物质的量是多少?
参考答案:(1)需耗MnO2?2.18g?(4分)(2)被氧化的HCl的物质的量是0.05mol。(6分)
本题解析:略
本题难度:一般
3、选择题 高氯酸铵在强热条件下分解,生成氮气、氧气、氯化氢和水。反应中生成的还原产物和氧化产物的物质的量之比是?
A.1∶2
B.5∶4
C.4∶7
D.7∶4
参考答案:C
本题解析:
4NH4ClO4 2N2↑+4HCl+5O2↑+6H2O
2N2↑+4HCl+5O2↑+6H2O
还原产物为HCl
氧化产物为N2,O2,
比值为4∶(5+2)=4∶7。
本题难度:一般
4、填空题 二氧化氯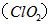 是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,
是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,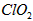 不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在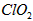 的制备方法中,有下列两种制备方法:
的制备方法中,有下列两种制备方法:
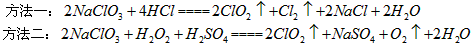
用方法二制备的更适合用于饮用水的消毒,其主要原因是_____________________。
(2)用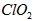 处理过的饮用水pH(为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子
处理过的饮用水pH(为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子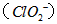 。
。
2001年我国卫生部规定,饮用水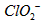 的含量应不超过0.2
的含量应不超过0.2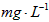 。 饮用水中
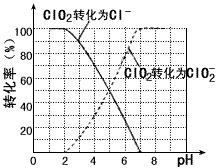
。 饮用水中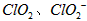 的含量可用连续碘量法进行测定。被还原为
的含量可用连续碘量法进行测定。被还原为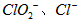 的转化率与溶液PH的关系如图所示。当
的转化率与溶液PH的关系如图所示。当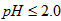 时,也能被
时,也能被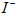 完全还原成
完全还原成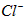 。反应生成的
。反应生成的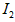 用标准
用标准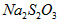 溶液滴定:
溶液滴定:
① 请写出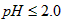 时,
时,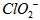 与
与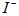 反应的离子方程式________________________。
反应的离子方程式________________________。
②请完成相应的实验步骤:
步骤1:准确量取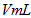 水样加入到锥形瓶中。
水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0
步骤3:加入足量的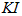 晶体。
晶体。
步骤4:加少量淀粉溶液,用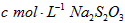 溶液滴定至终点,消耗溶液
溶液滴定至终点,消耗溶液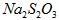
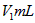 。
。
步骤5:_____________________________。
步骤6;再用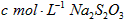 溶液滴定至终点,消耗
溶液滴定至终点,消耗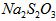 溶液
溶液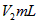 。
。
③根据上述分析数据,测得该引用水样中的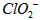 的浓度为______________
的浓度为______________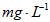 (用含字母的代数式表示)。
(用含字母的代数式表示)。
④若饮用水中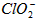 的含量超标,可向其中加入适量的,该反应的氧化产物是______________(填化学式)
的含量超标,可向其中加入适量的,该反应的氧化产物是______________(填化学式)
参考答案:(1)方法二制备的ClO2中不含Cl2
(2)①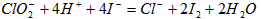 ;②调节溶液的
;②调节溶液的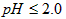 ;③
;③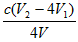 ;
;
④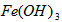
本题解析:
本题难度:困难
5、选择题 饱和氯水长期放置后,下列微粒在溶液中不减少的是( )
A.HClO
B.Cl2
C.Cl-
D.ClO-
参考答案:新制饱和氯水中存在Cl2+H2O?HClO+HCl,由于HClO见光分解,导致平衡右移,长期放置,Cl2和HClO、ClO-减少,HCl增多,则Cl-增大.
故选:C.
本题解析:
本题难度:一般