Cl2
参考答案:B
本题解析:A中反应需要加热,不正确;C不正确,氢气的密度小于空气的,应该用向下排空气法收集;实验室制备氯气也是需要加热的,D不正确,答案选B。
点评:该题是基础性试题的考查,试题注重基础,侧重考查学生的基础知识,有助于巩固学生的基础知识,提高学生分析问题、解决问题的能力。该题的关键是记住常见气体的制备原理,然后灵活运用即可。
本题难度:简单
2、实验题 (12分)天然水是人类饮用水的主要来源。从天然水获得可以饮用的水一般须经过沉降悬浮物、杀菌消毒等步骤。
(1)沉降悬浮物要在水中加入絮凝剂,如将铝盐加入水中能达到净水目的,
原因是?(用离子方程式表示)。
(2)氯气可用于自来水杀菌消毒剂,结合离子方程式和文字理由?。
(3)新型水处理剂高铁酸钾 (K2FeO4)具有强的氧化作用和絮凝作用。工业上可通过以下流程制备高铁酸钾:
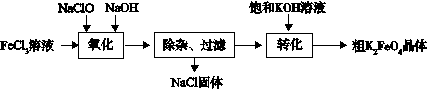
查阅资料:高铁酸盐在中性或酸性溶液中会逐渐分解,在碱性溶液中稳定。
完成“氧化”过程中的离子方程式
□Fe3+ + □ClO- +□??="□" FeO42- + □Cl- +?□?
“转化”过程中实现由Na2FeO4制得K2FeO4,是利用二者?性的不同。
③结合资料完成粗K2FeO4晶体的提纯:将粗产品用?溶解,然后再加入饱和KOH溶液、冷却结晶、过滤。
④高铁酸钾的应用还在不断扩展中。如可制成高铁电池,?电池反应为:
3Zn?+?2K2FeO4?+?8H2O  ?3Zn(OH)2?+?2Fe(OH)3?+?4KOH? ?3Zn(OH)2?+?2Fe(OH)3?+?4KOH?
放电时,正极反应为:?。
参考答案:(12分)
(1)Al3++3H2O Al(OH)3(胶体)+ 3 H+?(2分) Al(OH)3(胶体)+ 3 H+?(2分)
(2) Cl2 + H2O =" HCl" + HClO,生成的HClO有强氧化性,具有杀菌消毒作用。
(2分)
(3)① 2Fe3+ + 3ClO- + 10 OH- = 2FeO42- + 3Cl- +5H2O?(2分)
②溶解?(2分)
③稀KOH溶液,?(2分)
④ 2FeO42-+6e-+8H2O==2Fe(OH)3+10OH-?(2分)
本题解析:(1)铝盐加入水中能达到净水目的,是因为铝离子水解得氢氧化铝胶体,具有吸附作用,离子方程式是Al3++3H2O Al(OH)3(胶体)+ 3 H+ Al(OH)3(胶体)+ 3 H+
(2)氯气溶于水生成次氯酸,Cl2 + H2O =" HCl" + HClO,次氯酸具有强氧化性,用来杀菌消毒;
(3)①根据题目的流程图判断反应物中有氢氧化钠,所以反应物的空白处应是OH-,则产物的空白处应是H2O,根据得失电子守恒,配平该化学方程式,答案是2Fe3+ + 3ClO- + 10 OH- = 2FeO42- + 3Cl- +5H2O?;
②“转化”过程中实现由Na2FeO4制得K2FeO4,是利用二者溶解性的不同,K2FeO4比Na2FeO4的溶解度小;
③高铁酸盐在中性或酸性溶液中会逐渐分解,在碱性溶液中稳定,所以将粗产品用稀KOH溶液溶解;
④放电时,将化学能转化为电能,正极发生还原反应,电极方程式为2FeO42-+6e-+8H2O==2Fe(OH)3+10OH-
本题难度:一般
3、实验题 在没有现成的CO2气体发生器的情况下,请你选用下图所示部分仪器,装配成一个简易的、能随开随用、随关随停的CO2气体发生装置。

(1)应选用的仪器是________________(填入编号);
(2)若用上述装置制取CO2气体,而实验室只有稀硫酸、浓硝酸、水、块状纯碱、块状大理石,比较合理的方案,应选用的药品是________?_________。
参考答案:(1)a、c、d、e (2)浓硝酸、水、块状大理石
本题解析:(1)根据二氧化碳的反应原理和反应物的状态,其反应发生装置需要组成“固液不加热型”,按照此思路去选择仪器。由于题目要求装配成一个能随开随闭的二氧化碳气体发生装置,因此可以根据启普发生器的特点来进行选择,则盛固体药品的反应容器选择e,液体盛放在烧杯d中,通过弹簧夹来控制反应的进行与否,所以选择的仪器是a、c、d、e。(2)根据(1)的装置可以知道应该选择稀盐酸和块状的大理石来制取二氧化碳。2制备实验装置的选择
点评:该题是基础性试题的考查,主要考查了常用气体的发生装置和收集装置的选取方法,有利于调动学生的学习兴趣,激发学生的学习积极性。答题要注意如果不是典型的实验仪器,尽量选择合适的仪器。
本题难度:一般
4、填空题 (12分)手持技术又称掌上技术,是由数据采集器、传感器和配套的软件成
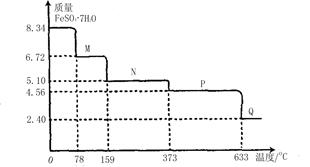
的定量采集各种常见数据并能与计算机连接的实验技术系统。某研究小组利用手持技术,获得8.34gFeS04·7H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定78℃时固体物质M的化学式:?。
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成且两种气体的组成元素相同,摩尔质量相差16,写出该反应的化学方程式?。
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响)。
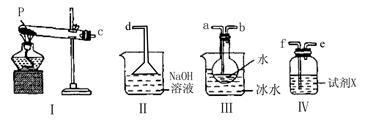
①试剂X的名称是?。
②按气流方向连接各仪器,用字母表示接口的连接顺序:c?。
③充分反应后,利用装置Ⅲ中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。第三步:继续烘干、冷却并称量直至连续两次 称量的质量差不超过0.1g为止。若最终得到沉淀的质量为Wg,则已分解的P的质量为??(填计算式)。
④上述测得P的质量比实际分解质量要小,原因是?。
参考答案:(1)FeS04·4H20?(2)2FeSO4 Fe2O3+SO2↑+SO3↑ Fe2O3+SO2↑+SO3↑
(3)①品红溶液或溴水或酸性高锰酸钾溶液?
②a b b f f e e d?③ d?③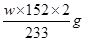
④由于生成的三氧化硫并没有完全被吸收,导致生成的硫酸钡质量减少
本题解析:(1)8.34gFeS04·7H20的物质的量是8.34g÷278g/mol=0.03mol,78℃是固体质量减少了8.34g-6.72g=1.62g,即相当于水的物质的量是1.62g÷18g/mol=0.09mol,所以固体中含有的结晶水是0.03mol×7-0.09mol=0.12mol,则化合物中含有的水分子个数是0.12mol÷0.03mol=4,则化学式是FeS04·4H20。
(2)固体加热到373℃时固体质量减少了8.34g-4.56g=3.78g,即相当于水的物质的量是3.78g÷18g/mol=0.21mol,这说明此时水已经完全失去。又因为两种气体的组成元素相同,摩尔质量相差16,所以该物质是二氧化硫和三氧化硫,因此反应的化学方程式是2FeSO4 Fe2O3+SO2↑+SO3↑。 Fe2O3+SO2↑+SO3↑。
(3)①二氧化硫具有漂白性和还原性,所以检验二氧化硫可以用品红溶液或溴水或酸性高锰酸钾溶液。
②三氧化硫溶于水生成硫酸,所以首先要通过冷却水得到三氧化硫,又因为二氧化硫是大气污染物,需要尾气处理,所以正确的顺序是c a a b b f f e e d。 d。
③根据题意最终得到的白色沉淀是硫酸钡,由于生成的硫酸来自于三氧化硫,所以根据S原子守恒可知,分解的硫酸亚铁的质量是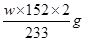 。 。
④由于生成的三氧化硫并没有完全被吸收,导致生成的硫酸钡质量减少,所以测得P的质量比实际分解质量要小。2的检验、三氧化硫的分离等
点评:固体是高考中的常见题型,属于较难的实验题。试题既有定性的分析,也有定量的计算,学生不易得分。本题用图表表述化学过程或呈现背景信息是化学常用的表达方式。图表往往拥有较大的信息存储量,能够很全面地考查学生分析、比较、概括、归纳问题的能力。
本题难度:一般
5、选择题 不能用排水法收集的气体有( ?)
A.NO
B.H2
C.NO2
D.CO
参考答案:C
本题解析:排水法收集气体的要求是:该气体不溶于水,不与水发生反应。依据题意,可知C项NO2会与水发生反应,故不能用排水法收集。
点评:本题主要考查排水法收集气体的要求,属于基础题,解题的关键是结合题干气体是否溶于水,与水反应。
本题难度:简单
|