微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (12分)Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操 作几次。
作几次。
请你评价若用上述方法制取乙醛存在哪些不足(写出两点)。
?。
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管 。请填写下列空白:
。请填写下列空白:
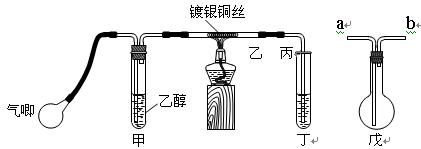
(1)甲装置常常浸在70~80℃的水浴中,目的是?。
(2)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
①乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为?。
②控制鼓气速度的方法是?,若鼓气速度过快则会?,若鼓气速度过慢则会?。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接?、_______接丙;若产物不用水吸收而是直接冷却,应将试管丁 浸在 _____?中。
浸在 _____?中。
参考答案:
Ⅰ.操作麻烦、乙醇转化率低(其它合理答案均可)(2分)
Ⅱ.(1)使生成乙醇蒸气的速率加快(1分)
(2)①放热?(1分)? 2CH3CH2OH+O2 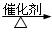 2CH3CHO+2H2O?(2分)
2CH3CHO+2H2O?(2分)
②控制甲中单位时间内的气泡数?
带走过多热量,难以保证反应所需温度?
反应放热太少,不能达到反应所需温度?(3分)
(3) b? a?(2分)?冰水?(1分)
本题解析:略
本题难度:简单
2、选择题 香烟烟雾中含有CO、CO2、SO2、H2O等气体.用a.无水硫酸铜b.澄清石灰水c.红热氧化铜d.生石灰e.品红溶液等可将其一一检出,检出的正确顺序是( )
A.混合气→a→e→e→b→d→c
B.混合气→c→d→e→e→a
C.混合气→a→e→b→a→d→c
D.混合气→b→e→a→d→c
参考答案:先用a检测出水,无水硫酸铜变蓝,因为后面一些步骤中会有水产生,且空气中的水蒸气可能也会影响检测结果;
再用e检测二氧化硫,二氧化硫使品红溶液褪色;
再用e将多有的二氧化硫除去(或者说检测二氧化硫是否除尽),因为如果不除尽,二氧化硫会影响后面的实验;
再用b检测二氧化碳并除去过量的二氧化碳,二氧化碳使澄清石灰水变混浊;
用d生石灰来干燥气体,
再用c来检测CO,红热氧化铜由黑色变成红色;
最后用b检验生成物是否是二氧化碳.
则正确的顺序为混合气→a→e→e→b→d→c,
故选A.
本题解析:
本题难度:一般
3、选择题 下列实验可行的是( )
A.用酒精萃取碘水中的碘
B.加入盐酸以除去硫酸钠溶液中的少量碳酸钠杂质
C.加热氯化铵与氢氧化钙的固体混合物制取氨
D.在容量瓶中加入少量的水,再加入浓硫酸配制一定物质的量浓度的稀硫酸
参考答案:A.酒精与水混溶,不能作萃取剂,则应用苯或四氯化碳萃取碘水中的碘,故A错误;
B.盐酸与碳酸钠反应生成NaCl,会引入新杂质,则应加入硫酸以除去硫酸钠溶液中的少量碳酸钠杂质,故B错误;
C.氯化铵与氢氧化钙反应生成氨气、氯化钙、水,为固体加热制取氨气的原理,实验方案可行,故C正确;
D.不能在容量瓶中稀释浓硫酸,应在烧杯中稀释、冷却后转移到容量瓶中,故D错误;
故选C.
本题解析:
本题难度:简单
4、实验题 (每空1分,共6分)下面是某科学兴趣小组的同学做同周期元素性质递变规律实验时,设计的一套实验方案。其中实验步骤如下:
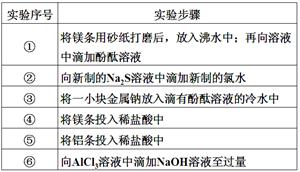
请整理并完成实验报告:
(1)实验目的:?。
(2)实验用品:
试剂:金属钠、镁条、铝条、稀盐酸、新制氯水、新制Na2S溶液、AlCl3溶液、NaOH溶液等。
仪器:?、酒精灯、表面皿、试管夹、镊子、小刀、玻璃片、砂纸等。
(3)实验内容(完成下列表格中的未完成的实验现象和化学方程式):
实验序号
| 实验现象
| 化学方程式
|
①
| 有气体产生,溶液变成浅红色
| ?
|
②
| 生成浅黄色沉淀
| Na2S+Cl2=2NaCl+S↓
|
③
| ?
| 2Na+2H2O=2NaOH+H2↑
|
④
| 剧烈反应,迅速产生无色气体
| Mg+2HCl=MgCl2+H2↑
|
⑤
| 反应不十分剧烈,产生无色气体
| 2Al+6HCl=2AlCl3+3H2↑
|
⑥
| 开始时生成白色胶状沉淀,继而沉淀消失
| AlCl3+3NaOH=Al(OH)3↓+3NaCl
Al(OH)3+NaOH=NaAlO2+2H2O
|
(4)实验结论:?。
(5)请用原子结构的知识简单解释上述结论:?。
参考答案:(每空2分,共6分)
(1)实验目的:探究同周期元素性质的递变规律
(2)实验用品:仪器:试管
(3)实验内容:
实验现象:浮在水面上,熔成小球,有气体放出,做不定向移动,随之消失,溶液变成红色
化学方程式:Mg+2H2O Mg(OH) 2+2H2↑
Mg(OH) 2+2H2↑
(4)实验结论:同周期元素随原子序数的递增,失电子能力逐渐减弱,得电子能力增减增强。
(5)请用原子结构的知识简单解释上述结论::同周期元素的原子电子层数相等,核电荷数逐渐减小,原子核对核外电子的吸引能力逐渐增强,电子能力逐渐减弱,得电子能力增减增强。
本题解析:(1)根据实验步骤和原理可知,实验目的是探究同周期元素性质的递变规律。
(2)根据实验步骤可知,实验需要试管。
(3)①镁是活泼的金属,在加热的条件下能和沸水反应生成氢气和氢氧化镁,方程式为Mg+2H2O Mg(OH) 2+2H2↑。
Mg(OH) 2+2H2↑。
③钠是活泼的金属,极易和水反应生成氢气和氢氧化钠,所以实验现象是浮在水面上,熔成小球,有气体放出,做不定向移动,随之消失,溶液变成红色。
(4)根据实验现象可知,结论应该是同周期元素随原子序数的递增,失电子能力逐渐减弱,得电子能力增减增强。
(5)由于同周期元素的原子电子层数相等,核电荷数逐渐减小,原子核对核外电子的吸引能力逐渐增强,失去电子的能力逐渐减弱,得电子能力增减增强,所以金属性逐渐减弱,非金属性逐渐增强。
本题难度:一般
5、实验题 已知某混合金属粉末,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1 mol/L硫酸、2 mol/L
硝酸、2 mol/L NaOH溶液、20% KSCN溶液。
完成以下实验探究过程:
(1)提出假设:
假设1:该混合金属粉末中除铝外还含有_________元素;
假设2:该混合金属粉末中除铝外还含有_________元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案基于假设3,设计出实验方案(不需要作答)。
(3)实验过程根据(2)的实验方案,叙述实验操作、预期现象和结论。

参考答案:(1)Cu;Fe(3)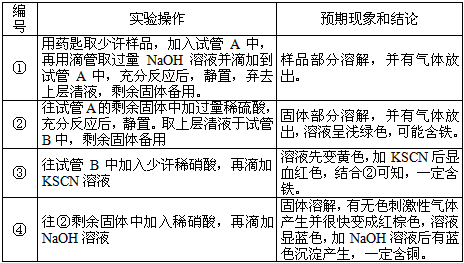
本题解析:
本题难度:一般