微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 26.(14分)铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
(1)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式 ;
(2)已知铜与稀硫酸不反应,但将铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示原因 。
(3)氯化铝广泛用于有机合成和石油工业的催化剂。将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式________________________。
(4)已知Cu2S可以和硝酸反应,请配平下列化学反应方程式:
□Cu2S+□HNO3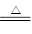 □CuSO4 +□ Cu(NO3)2+□NO↑+ □
□CuSO4 +□ Cu(NO3)2+□NO↑+ □
(5)某校兴趣小组欲测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g。向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧得红棕色粉末1.60g,通过计算确定此合金的组成为 (填化学式)。
参考答案:(1)2Fe3+ + Cu ="=" 2Fe2+ + Cu2+
(2)2Cu+O2+2H2SO4 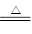 2CuSO4+2H2O
2CuSO4+2H2O
(3)Al2O3 + 3Cl2 + 3C 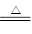 2AlCl3 + 3CO↑
2AlCl3 + 3CO↑
(4)3,16, 3, 3,10 , 8H2O
(5)Fe8Al4Si
本题解析:(1)FeCl3蚀刻铜箔反应是三价铁离子具有氧化性和铜反应生成亚铁离子和铜离子,反应方程式为2Fe3+ + Cu ="=" 2Fe2+ + Cu2+;(2)因溶液中有O2,加热能使铜生成氧化铜,氧化铜再与硫酸反应生成硫酸铜,总反应为2Cu+O2+2H2SO4 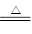 2CuSO4+2H2O;(3)根据题意可得,反应物为氧化铝、C和Cl2,反应条件是加热,生成物是氯化铝和CO,因而反应方程式为Al2O3 + 3Cl2 + 3C
2CuSO4+2H2O;(3)根据题意可得,反应物为氧化铝、C和Cl2,反应条件是加热,生成物是氯化铝和CO,因而反应方程式为Al2O3 + 3Cl2 + 3C 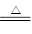 2AlCl3 + 3CO↑;(4)根据化合价的升降守恒对方程式进行配平,根据原子守恒可知生成物为H2O,得方程式为3Cu2S +16HNO3
2AlCl3 + 3CO↑;(4)根据化合价的升降守恒对方程式进行配平,根据原子守恒可知生成物为H2O,得方程式为3Cu2S +16HNO3 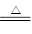 3CuSO4 +3 Cu(NO3)2+10NO↑+ 8H20;(5)准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g,由于铝和铁均可溶于盐酸,因而0.07g固体为Si,向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧得红棕色粉末1.60g,足量的氢氧化钠使铝完全溶解,因而得到的红棕色粉末即为Fe2O3,计算可得n(Si)=
3CuSO4 +3 Cu(NO3)2+10NO↑+ 8H20;(5)准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g,由于铝和铁均可溶于盐酸,因而0.07g固体为Si,向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧得红棕色粉末1.60g,足量的氢氧化钠使铝完全溶解,因而得到的红棕色粉末即为Fe2O3,计算可得n(Si)=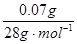 ="0.0025mol," n(Fe)=
="0.0025mol," n(Fe)=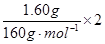 =0.02mol,m(Fe)=1.12g,那么m(Al)=0.27g,n(Al)=0.01mol,得n(Fe):n(Al):n(Si)=0.02:0.01:0.0025=8:4:1,故合金的组成为Fe8 Al4 Si。
=0.02mol,m(Fe)=1.12g,那么m(Al)=0.27g,n(Al)=0.01mol,得n(Fe):n(Al):n(Si)=0.02:0.01:0.0025=8:4:1,故合金的组成为Fe8 Al4 Si。
考点:金属及其化合物的性质及相关计算
点评:本题考查金属及其化合物的相关内容,范围较广,但难度中等,注意计算。
本题难度:困难
2、选择题 5NH4NO3=2HNO3+4N2↑+9H2O中,发生氧化反应与发生还原反应的氮原子个数之比 是?
是?
A.1∶3
B.5∶3
C.5∶8
D.5∶4
参考答案:B
本题解析:略
本题难度:一般
3、选择题 锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为? ( )。
A.2 mol
B.1 mol
C.0.5 mol
D.0.25 mol
参考答案:D
本题解析:依据Zn+HNO3(稀)―→Zn(NO3)2+NH4NO3+H2O,Zn:0―→+2,化合价改变值为2,N:+5―→-3,化合价改变值为8,根据化合价升降总值相等得:Zn(NO3)2的化学计量数为4,NH4NO3的化学计量数为1,然后根据原子守恒配平化学方程式为4Zn+10HNO3(稀)=4Zn(NO3)2+NH4NO3+3H2O,当生成1 mol Zn(NO3)2时,被还原的HNO3为0.25 mol。
本题难度:一般
4、填空题 金属钼(Mo)可以增强合金的某些机械性能和耐腐蚀性。下图是化工生产中制备金属铝的实验流程图(已知铝酸为难溶于水和酸的黄色晶体):

(1)在灼烧铝矿时发生化学反应: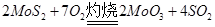 ,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
,该反应的还原剂是__________。当有1mol MoS2反应时,还原剂失去电子的物质的量为________。
(2)步骤①中,灼烧钼矿时,用于盛放固体的仪器的名称为________。
(3)写出步骤②中发生反应的离子方程式_________________________________。
(4)在步骤③中需要加入过量硝酸,检验硝酸过量的操作为_________________。
(5)某同学拟选用如下装置,用氢气还原三氧化铝,同时检验该反应的氧化产物,根据要求回答下列问题。
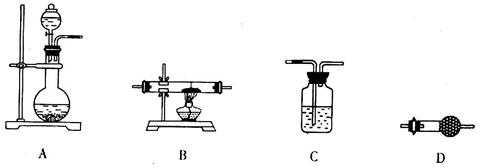
①若两次使用到C装置,则装置D中所盛的药品是________(填试剂名称)。
②根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞后______→______→______→______(请按正确的顺序填入下列步骤的代号)。
a.收集气体并检验其纯度? b.停止加热,充分冷却
c.加热反应一段时间? d.关闭分液漏斗活塞,停止通氢气
参考答案:(1)MoS2(1分)? 14mol(2分)
(2)坩埚(1分)
(3)2NH3·H2o+MoO3=2NH4++ MoO42-+H2O(2分)
(4)静置后,向上层清液中继续滴加硝酸,若无明显现象,则硝酸过量。(2分)
(5)①无水硫酸铜(2分)
②a→c→b→d(2分)
本题解析:(1)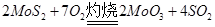 ,MoS2化合价升高为还原剂。1mol MoS2反应时,+4价Mo被氧化成+6价,-2价S被氧化成+4价 S,则失电子为14mol。
,MoS2化合价升高为还原剂。1mol MoS2反应时,+4价Mo被氧化成+6价,-2价S被氧化成+4价 S,则失电子为14mol。
(2)步骤①中,灼烧使用的一起为坩埚。
(3)(4)见答案
(5)①该反应的氧化产物为水,用无水硫酸铜检验。
②见答案
本题难度:一般
5、选择题 将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2CrO4溶液,发生的两个化学反应为SO2+2Fe3++2H2O=SO42-+2Fe2++W ①,Cr2O72-+aFe2++bH+
参考答案:
本题解析:
本题难度:一般