|
高中化学必备知识点《未知》高频试题巩固(2017年最新版)(四)
2017-07-18 02:13:55
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 Ⅰ.2011年4月27日某市工商局查获400克袋装中老年补钙营养奶粉1 401包。这种奶粉被鉴定为所含亚硝酸盐残留量高出正常值7.8倍,长期食用可能致癌。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是_____,若有0.75 mol的还原剂被氧化,则被还原的氧化剂有_____mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①自来水;②淀粉碘化钾试纸;③淀粉;④白糖;⑤食醋;⑥白酒。进行实验时,必须选用的物质有____________。
(3)某工厂废切削液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂中_____(填序号)能使NaNO2转化为不引起二次污染的N2反应的化学方程式为________________________ (并标出电子转移的数目和方向)。
①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
(4)下列离子在溶液中一定能大量共存的是________。
A.NH Cl- OH- CO Cl- OH- CO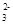
B.Fe2+ NO3- Cl- H+
C.CH3COO- NH H+ Cl- H+ Cl-
D.CH3COO- Na+ Cl- SO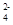
| Ⅱ.实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应式为
4CuI+Hg===Cu2HgI4+2Cu。
(1)上述反应产物Cu2HgI4中,Cu元素是________价。
(2) CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式:
 Cu2++ Cu2++ I-=== I-=== CuI+ CuI+ I I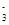
参考答案:Ⅰ(1)NaNO2 0.75 (2)②⑤
(3)② (4)D (4)D
Ⅱ.(1)+1 (2) 2Cu2++5I-===2CuI+I3-
本题解析:Ⅰ(1)根据反应的方程式可知,亚硝酸钠中氮元素的化合价从+3价降低到+2价,得到1个电子,所以亚硝酸钠是还原剂。HI中I元素的化合价从-1价升高到0价,失去1个电子,则根据电子得失守恒可知,若有0.75 mol的还原剂被氧化,则被还原的氧化剂有0.75mol。
(2)根据反应的方程式可知,该反应是在酸性条件下进行的,所以必须选用的物质有淀粉碘化钾试纸和食醋,答案选②⑤。
(3)使NaNO2转化为不引起二次污染的N2,这说明在反应中亚硝酸钠是氧化剂,得到电子,所以选择的应该是还原剂,NH4+中的氮元素处于最低价态,具有还原性,所以选择的试剂是氯化铵,即答案选②,反应的方程式是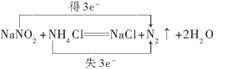 。 。
(4)A中的OH-与NH4+不能大量共存;B中溶液显酸性,则NO3-能氧化Fe2+不能大量共存;C中的CH3COO-和H+不能大量共存,所以答案选D。
Ⅱ.(1)在Cu2HgI4中,Hg显+2价,I是-1价,所以铜是+1价。
(2)在反应中铜的化合价从+2价降低到+1价,得到1个电子,而碘元素碘化合价从-1价升高到0价,失去1个电子,则根据电子的得失守恒可知,配平后的方程式应该是2Cu2++5I-===2CuI+I3-。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是准确标出有关元素的化合价变化情况,然后依据有关的概念,并结合电子得失守恒进行列式计算和判断即可。
本题难度:一般
2、填空题 (12分)(1)一个体重50 kg的健康人身体中含铁2 g。铁在人体中不是以游离态的形式存在,而是以Fe2+和Fe3+形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的Fe3+转化为Fe2+,利于铁的吸收。人体中经常进行Fe2+和Fe3+的转化,反应中,Fe2+作?剂,Fe3+作?剂。“服用维生素C,可使食物中的Fe3+转化为Fe2+”,说明维生素C在反应中做?剂,具有?性。
(2)在热的稀硫酸溶液中溶解了11.4 g FeSO4。当加入50 mL 0.5 mol/L KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
FeSO4 + ?KNO3 + ?H2SO4 =?K2SO4 + ?Fe2(SO4)3 + ?NxOy + ?H2O
①配平该化学方程式,用单线桥标出电子转移的方向和数目。
②反应中氧化剂为?,x=?,y=
(3)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是?。
参考答案:(1)还原;氧化;还原;还原;(2)①6,2,4-1,3,2,4;②KNO3;1;1;(3)N2O
本题解析:略
本题难度:一般
3、简答题 某反应体系的物质有:H2SO4、KMnO4、MnSO4、CO2、K2C2O4、K2SO4、H2O.(已知CO2为生成物)
(1)将上述物质填入以下空格内,组成一个配平的化学反应方程式,并标出电子转移数目.

(2)上述反应中,被氧化的元素是______,氧化产物是______.
(3)当有1mol的氧化剂参加反应时,转移的电子数是______mol.
参考答案:(1)高锰酸钾有强氧化性,所以选高锰酸钾作氧化剂,K2C2O4中C的化合价为+3价,CO2中C的化合价为+4价,要选择失电子的物质作还原剂,所以选,K2C2O4作还原剂,由高锰酸钾生成硫酸锰需硫酸参加反应,根据反应前后元素守恒,水在生成物中.
该反应中化合价的变化为:KMnO4→MnSO4,Mn元素由+7价→+2价,一个KMnO4分子得5个电子;K2C2O4→CO2,C元素由+3价→+4价,一个K2C2O4失去2个电子,所以得失电子的最小公倍数为10,所以KMnO4的计量数为2,K2C2O4的计量数为5,其它元素根据原子守恒配平.
故答案为:
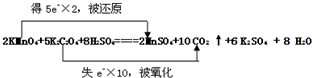
(2)该反应中,K2C2O4→CO2,C元素由+3价→+4价,所以K2C2O4是还原剂,碳元素被氧化,氧化产物是CO2;
故答案为:碳;?CO2.
(3)2KMnO4+5K2C2O3+8H2SO4=2MnSO4+10CO2+8H2O+6K2SO4 转移电子
? 2mol? 10mol
? 1mol?5mol
故答案为:5.
本题解析:
本题难度:一般
4、实验题 (18分)金属钛素有“太空金属”、“海洋金属”、“未来金属”等美誉,我国有丰富的钛矿资源。
(1)钛冶炼的旧法是用金属钠热还原四氯化钛。
请回答下列问题:
①试推测,在金属系列中,钛属于?(填“较活泼”或“较不活泼”)的金属。金属钛耐腐蚀可能原因是?。
②TiC14 工业上是用过量焦炭、氯气与TiO2在高温下反应制得的,该反应的化学方程式为?。
(2)已知化合态的钛:有+4价和+3价,其中+3价极易被氧化。有关氢氧化物开始沉淀的pH如表l
表l?有关氢氧化物开始沉淀的pH
氢氧化物
| Ti(OH)4
| Ti(OH)3
| Fe(OH)3
| Fe(OH)2
| pH
| 0.5
| 3.0
| 1.5
| 7.6
|
某地钛铁矿的主要成分为FeTiO3,含有少量杂质Al2O3、SiO2,提纯TiO2并得到副产品绿矾(FeSO4·7H2O)的工艺流程如图l所示。
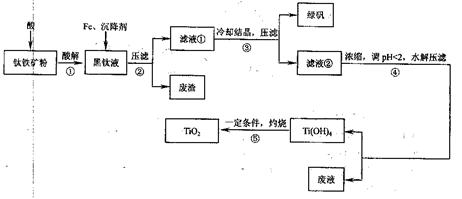
图1?工艺流程图
黑钛液中生成的主要阳离子有TiO2+、Fe2+,写出反应①主要的化学方程式:?;加入Fe的目的是?;步骤④生成Ti(OH)4的离子方程式:?。
(3)钛冶炼的新法是电解法,图2是一种电解制钛的工艺(OS法)示意图。CaC12/CaO共熔体为质,在阴极,被还原的Ca进一步还原TiO2得到钛,写出阴极制得钛的有关反应方程式?。
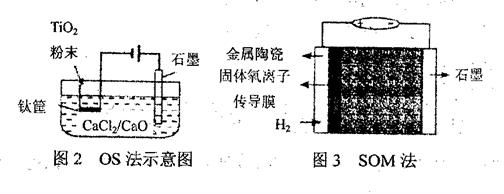
(4)我国科学最新研发的技术——固体透氧膜提取金属钛(SOM)工艺(见图3):将钛氧化物(钛全看作Ti4+)矿熔于MCl—MF融盐体系(M为Na、K、Ca等),以石墨为阴极,阳极为覆盖氧渗透膜的多孔金属陶瓷涂层。固体透氧膜把阳极和熔融电解质隔开,只有氧离子可以通过,电解过程中阴极通入H2,则阳极电极反应式为?。
参考答案:

本题解析:略
本题难度:一般
5、选择题 13克锌与足量的稀硫酸反应后,得到的氢气若在空气中完全燃烧,能生成水的质量为( ? )
A.14.4克
B.9克
C.7.2克
D.3.6克
参考答案:D
本题解析:
本题难度:简单
|
 Cu2++
Cu2++ I-===
I-=== CuI+
CuI+ I
I