微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)氨气是一种重要的化工原料,但随着工业化进程的加快,氨气也逐渐变成居室里一种重要的污染性气体。
(1)液氨和水类似,也能发生电离:NH3+NH3 NH4++NH2-,其离子积常数为l.0xl0-30。现将2.3g金属钠投入1.0 L液氨中,则液氨电离平衡____ 移动(填“不”、“正方向”、“逆方向”);待反应结束后,假设溶液的体积不变,所得溶液中NH4+的浓度为____ 。
NH4++NH2-,其离子积常数为l.0xl0-30。现将2.3g金属钠投入1.0 L液氨中,则液氨电离平衡____ 移动(填“不”、“正方向”、“逆方向”);待反应结束后,假设溶液的体积不变,所得溶液中NH4+的浓度为____ 。
(2)实验室模拟工业上用氮气和氢气合成氨气时,在反应前将两种气体通过图装置,该装置的作用有三个

①将氮气和氢气干燥:
②使氮气和氢气充分混合;
③____ ,从而提高氮气和氢气的利用率。
(3)实验室可用氨气通过红热的氧化铜制取氮气,写出该反应的化学方程式:____ 。
(4)家庭空气中的氨主要来自建筑施工中使用的混凝土外加剂,如混凝土防冻剂尿素会和水缓慢发生反应:CO(NH2)2(s)+H2O(g) 2NH3(g) +CO2(g),该反应的平衡常数表达式为K= 。
2NH3(g) +CO2(g),该反应的平衡常数表达式为K= 。
(5)已知:N2(g)+O2(g)=2NO(g); △H=180Kj·mol-l
4NH3(g)+5O2(g) =4NO(g)+6H2O(g); △H= -908Kj·mol-l
请写出氨气被一氧化氮氧化生成氮气和气态水的热化学方程式: 。
参考答案:(1)正方向;1.0×l0-29mol/L (2)通过观察气泡控制氮气和氢气的流量,使氮气和氢气的量达到最佳比例;(3)2NH3+3CuO 3Cu+N2+3H2O (4)
3Cu+N2+3H2O (4)
(5)4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1808KJ/mol。
本题解析:(1)将2.3g金属钠投入1.0L液氨中发生反应为:2Na+2NH3=2NaNH2+H2↑;促进液氨的电离,依据:NH3+NH3=NH4++NH2-,[NH4+][NH2-]=l.0×l0-30;反应生成NH2-物质的量为0.1mol;浓度为0.1mol/L,所得溶液中NH4+的浓度l.0×l0-29mol/L,答案为:正方向;1.0×l0-29mol/L;
(2)该装置的作用有三个将氮气和氢气干燥,使氮气和氢气充分混合,控制氮气和氢气通入的比例和通入的快慢,提高原料的利用率,答案为:通过观察气泡控制氮气和氢气的流量,使氮气和氢气的量达到最佳比例;
(3)用氨气通过红热的氧化铜制取氮气,依据氧化还原反应的化合价升降相同,氧化铜中铜的元素化合价降低生成铜,反应的化学方程式为:2NH3+3CuO 3Cu+N2+3H2O,答案为:2NH3+3CuO
3Cu+N2+3H2O,答案为:2NH3+3CuO 3Cu+N2+3H2O;
3Cu+N2+3H2O;
(4)CO(NH2)2(s)+H2O(g)?2NH3(g)+CO2(g),依据化学平衡,结合平衡常数的计算式列式:平衡常数是用平衡时生成物的浓度幂次方乘积除以反应物的幂次方乘积,得到平衡常数表达式:K= ;
;
(5)①N2(g)+O2(g)=2NO(g);△H=180Kj?mol-l②4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-908Kj?mol-l氨气被一氧化氮氧化生成氮气和气态水的热化学方程式依据盖斯定律,结合热化学方程式合并计算:①×5+②得到:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1808KJ/mol。
考点:考查影响平衡的因素,平衡常数表达式,热化学方程式的书写。
本题难度:困难
2、选择题 下列说法中不正确的是( )
A.将纯水加热至高温度,水的离子积变大,pH减小,呈中性
B.氨水和盐酸混合后溶液呈酸性,溶液中离子浓度大小关系一定存在:c(NH4+)>c(H+)
C.相同温度下,pH=2的醋酸溶液与pH=2的盐酸中c(H+)之比为1:1
D.对于酸性废水和碱性废水一般可以采用中和法处理,对于高浓度的酸、碱废水,应优先考虑回收利用
来源:91考试网 91exam.org
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列方程式书写正确的是
[? ]
A.HCO3-在水溶液中的电离方程式:HCO3-+H2O H3O++CO32-
H3O++CO32-
B.H2SO3的电离方程式H2SO3 2H++SO32-
2H++SO32-
C.CO32-的水解方程式:CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的电离方程式:CaCO3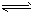 Ca2++CO32-
Ca2++CO32-
参考答案:A
本题解析:
本题难度:简单
4、选择题 纯水在25℃时的氢离子浓度与90℃时的氢离子浓度的关系是
[? ]
A.大于
B.等于
C.小于
D.不能肯定
参考答案:C
本题解析:
本题难度:简单
5、实验题 滴定实验是化学学科中重要的定量实验。
请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是 (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定——取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
滴定次数
| 待测液体积
(mL)
| 标准KMnO4溶液体积(mL)
|
滴定前读数
| 滴定后读数
|
第一次
| 25.00
| 0.50
| 20.40
|
第二次
| 25.00
| 3.00
| 23.00
|
第三次
| 25.00
| 4.00
| 24.10
|
①滴定时,KMnO4溶液应装在 (填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是
②该草酸溶液的物质的量浓度为_____________。
(3)沉淀滴定
参考答案:
本题解析:
本题难度:困难