| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《水的电离平衡》试题特训(2017年最新版)(六)
参考答案:C 本题解析: A、取NaOH溶液时仰视读数,会使氢氧化钠的体积偏多,造成消耗盐酸的体积偏多,测定结果偏高,错误;B、滴定结束后,滴定管尖嘴处有一悬挂液滴,对结果无影响,错误;C、锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度,会造成假滴定 终点的判断,使消耗盐酸的体积偏少,测定结果偏低,正确;D、盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2次~3次,会使氢氧化钠的体积偏多,造成消耗盐酸的体积偏多,测定结果偏高,错误,答案选C。 本题难度:一般 2、选择题 下列微粒中,对水的电离平衡不产生影响的是( ) 参考答案:B 本题解析: 本题难度:一般 3、选择题 常温下,向20.00mL0.1000mol·L-1(NH4)2SO4溶液中逐滴加入0.2000mol·L-1NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑NH3·H2O的分解)。下列说法不正确的是 |
参考答案:B
本题解析:(NH4)2SO4是强酸弱碱盐,其溶液显酸性,故点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-),A对,不选;NH4+水解是微弱的,所以溶液显中性时加入的NaOH溶液量是少量的,故c(NH4+)>c(Na+),B错,选B;c(NH4+)+c(H+)+ c(Na+)=c(OH-)+2c(SO42-)是电荷守恒,C对,不选;c(NH4+)+c(NH3·H2O)= 0.1000mol·L-1是物料守恒,D对,不选。选B。
考点:盐类水解和离子浓度的大小比较。
本题难度:困难
4、选择题 下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl
参考答案:
本题解析:
本题难度:一般
5、选择题 室温下,水的电离达到平衡:H2O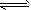 H++OH-。下列叙述正确的是
H++OH-。下列叙述正确的是
[? ]
A. 将水加热,平衡向正向移动,Kw不变
B. 向水中加入少量NaOH固体,平衡向逆向移动,c(OH-)增大
C. 新制氯水久置后,水的电离平衡向正向移动,c(OH-)增大
D. 向水中加入少量CH3COONa同体,平衡向正向移动,Kw增大
参考答案:B
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《电解质溶液.. | |