微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.物质的量就是物质的质量
B.阿伏加德罗常数就是6.02×1023
C.6.02×1023 mol-1叫做阿伏加德罗常数
D.科学上规定含有阿伏加德罗常数个粒子的任何粒子的集合体为1 mol
参考答案:D
本题解析:物质的量和质量分别是两个不同的基本物理量.物质的量符号为n,单位为mol,质量的符号为m,单位为g或kg,A项不正确;阿伏加德罗常数是指1 mol任何粒子集合体中的粒子数,其近似值为6.02×1023 mol-1,但不能说6.02×1023 mol-1叫做阿伏加德罗常数,更不能说6.02×1023就是阿伏加德罗常数,B、C两项错误;1 mol任何物质中所含粒子数为阿伏加德罗常数,D项正确.
本题难度:简单
2、选择题 见下表。欲用一种试剂甲来检验其溶液中的离子X,在同时有离子Y存在时,此检验仍可进行的是(在实验过程中不允许加热.过滤.萃取……等操作)
?
| 试剂甲
| 离子X
| 离子Y
|
A
| HCl.Ba(OH)2
| CO32-
| HCO3-
|
B
| NH3 .H2O
| Al3+
| Mg2+
|
C
| AgNO3
| I-
| Cl-
|
D
| NH4SCN,氯水
| Fe2+
| Fe3+
|
?
参考答案:C
本题解析:A.可以用Ba(OH)2来检验CO32-,但HCO3- 不能存在,错误;B.有离子Y:Mg2+,检验,不能存在,错误;C.AgI是黄色沉淀,AgCl是白色沉淀,Y:Cl- 不干扰它的检验,正确;D.Y:
Fe3+干扰检验,错误。
本题难度:一般
3、选择题 欲使混合物中的CuSO4·5H2O、NH4Cl、SiO2分离开,其必要的实验操作是(?)
A.升华 溶解 过滤 蒸发
B.溶解 过滤 萃取 分液
C.加热 溶解 过滤 结晶
D.溶解 过滤 分馏 结晶
参考答案:C
本题解析:先加热分离出NH4Cl,然后再溶解过滤得到SiO2固体和CuSO4溶液,最后蒸发结晶得到CuSO4·5H2O。
本题难度:简单
4、实验题 (13分)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质,不符合电解要求,因此必须经过精制.某同学设计了一种制备 精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸
调节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
(1)上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
(2)步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:
________________.
(3)步骤2中,判断加入BaCl2已过量的方法是:_______________________________
_______________________.
(4)步骤2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是
________________________________________________________________________.
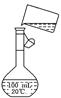 (5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,右图是该
(5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,右图是该
同学转移溶液的示意图,图中的两处错误是:
________________________________________________
________________________________________________.
若在定容时仰视,则所配溶液的浓度_____________________________________
0.2 mol/L(填“大于”或“小于”);若定容不慎超过刻度线,应采用的处理方法是: ________________________________________________________________________.
参考答案:(1)玻璃棒 漏斗;(2)NaOH→BaCl2→Na2CO3(或BaCl2→NaOH→Na2CO3);(3)取所得溶液的上层清液1~2滴于滴定板上,再滴入1~2滴BaCl2溶液,若溶液未变混浊,则表明BaCl2已过量;(4)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度;(5)未用玻璃棒引流;未采用150 mL容量瓶 小于 重新配制。
本题解析:过滤装置由铁架台(含铁圈)、玻璃棒、漏斗、烧杯、滤纸等组成.本着“除杂不掺杂”的原则,应使杂质变为沉淀或气体或本体物质,故使Ca2+、Mg2+、Fe3+、SO等离子变为沉淀,Ca2+常以碳酸钙形式沉淀,Mg2+可以氢氧化镁或碳酸镁形式沉淀,Fe3+常以氢氧化铁形式沉淀,SO常以硫酸钡形式沉淀,故应先加入BaCl2即可.判断加入BaCl2已过量的方法则应先取少量液体,加入BaCl2或碳酸钠即可.步骤2中,若先用盐酸调节pH再过滤,则会使出现的难溶碳酸盐再溶解,故应过滤后再加盐酸.由图可解答问题(5)缺少玻璃棒引流、容量瓶型号不对。
本题难度:一般
5、选择题 除去下列物质中的杂质选用试剂不正确的是( )
A.铁粉中混有铝粉:用烧碱溶液
B.FeCl2溶液中混有FeCl3:用过量铁粉
C.NaHCO3溶液中混有少量Na2CO3:用适量Ba(OH)2溶液
D.MgCl2溶液中混有少量AlCl3:用氢氧化钠溶液和盐酸
参考答案:A.金属铝能和强碱反应,而金属铁不能,除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,再过滤来实现目的,故A正确;
B.因为铁离子能和铁反应生成亚铁离子,化学方程式为2FeCl3+Fe═3FeCl2,故可用铁除去FeCl2溶液中的少量氯化铁,故B正确;
C.氢氧化钡能与碳酸氢钠和碳酸钠反应,将原物质除掉,故C错误;
D.氯化铝与过量的氢氧化钠反应生成偏铝酸钠,过滤得到氢氧化镁,然后加盐酸得到氯化镁,故D正确.
故选C.
本题解析:
本题难度:简单