微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 X元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成离子化合物Z,下列说法中不正确的是
[? ]
A.Z在一定条件下可以电离
B.Z可以表示为XY2
C.X形成+2价阳离子
D.Z的电子式为: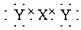
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列物质中属于离子化合物的是( )
A.苛性钾
B.碘化氢
C.硫酸
D.醋酸
参考答案:A
本题解析:
本题难度:一般
3、选择题 下列分子中既不存在s-p σ键,也不存在p-p π键的是
[? ]
A.HCl
B.HF
C.SO2
D.SCl2
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列物质中含离子键的是( )
A.Cl2
B.CO2
C.NaCl
D.CH4
参考答案:C
本题解析:
本题难度:一般
5、填空题 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)D的元素符号为______。A的单质分子中π键的个数为______。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是__________________________________。
(3)A、B、C 3种元素的第一电离能由大到小的顺序为________(用元素符号表示)。
(4)写出基态E原子的价电子排布式:__________________。
(5)A的最简单氢化物分子的空间构型为________,其中A原子的杂化类型是________。
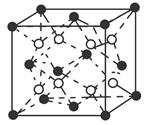
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,求晶胞边长a=________cm。(用ρ、NA的计算式表示)
参考答案:(1)Ca 2
(2)H2O分子间存在氢键
(3)F>N>O
(4)3d104s1
(5)三角锥形 sp3
(6)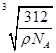
本题解析:根据题意及电子排布式的规律判断可知,元素A、B、C、D、E分别是N、O、F、Ca、Cu。(1)A单质是N2,其结构式是NN,含有两个π键。(2)由于H2O的分子间有氢键,使得其沸点是同族元素氢化物中最高的。(3)N的2p能级是半充满状态,比较稳定,其第一电离能比O要大,但比同周期的F要小。(5)NH3的空间构型是三角锥形,其中N是sp3杂化。(6)根据晶胞的结构,应用“均摊法”计算可得,1个晶胞中含有4个Ca2+,8个F-,故其密度为ρ=(312/NA)÷a3,解得a=?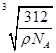 。
。
点拨:本题考查物质结构的推断,考查考生应用所学知识灵活解决问题的能力。难度中等。
本题难度:一般