微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 元素X、Y、Z原子序数之和为36,X、
Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测正确的是
A.同周期元素中X的最高价氧化物对应的水化物碱性最强
B.Y的最高价含氧酸的化学式可表示为H2YO4
C.同族元素中Z的氢化物稳定性最低
D.原子半径X>Y,离子半径X+>Z2-
参考答案:A
本题解析:略
本题难度:简单
2、选择题 六种短周期元素A、B、C、D、E、F的原子序数依次增大, C和F同族,B、C、D、E的离子均具有相同的电子层结构,E在同周期元素中离子半径最小。A和B、C、F均能形成共价型化合物,A和B形成的化合物Y在水中呈碱性,D和F形成的化合物在水中呈中性。下列说法错误的是
A.B、D离子的半径大小是B>D
B.C的单质能将F的单质从EF3的溶液中置换出来
C.化合物AC的沸点比化合物AF的高
D.化合物AF与化合物Y可形成含有共价键的离子化合物
参考答案:B
本题解析:A和B形成的化合物Y在水中呈碱性,A是H、B是N;A和D同族,D在N的后面,是Na,A和B、C、F均能形成共价型化合物,B、C、F均是非金属;D和F形成的化合物在水中呈中性,F是Cl(NaCl溶液为中性);C和F同族,C是F;B、C、D、E的离子均具有相同的电子层结构,E在同周期元素中离子半径最小,E是Al。A.B、D离子的半径大小是N3->Na+,正确(阴盛阳衰);B.C的单质(F2)直接与H2O反应,不能将Cl2从AlCl3的溶液中置换出来;C.化合物AC的沸点比化合物AF(HCl)的高,前者分子间可以形成氢键;D.化合物AF(HCl)与化合物Y(NH3)可形成含有共价键的离子化合物NH4Cl,正确。
本题难度:一般
3、选择题 A、B、C、D、E五种短周期元素,核电荷数依次增加。只有D为金属,A与D同主族,C与E同主族,B原子最外层电子数是内层电子数的2倍,D+与C3-具有相同的电子层结构。下列说法正确的是?(?)
A.C的氧化物都能跟碱反应
B.B的最高价氧化物的水化物是非电解质
C.C的氢化物与C的最高价氧化物的水化物能发生化合反应
D.稳定性: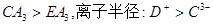
参考答案:C

本题解析:根据“B原子最外层电子数是内层电子数的2倍”,可以得出B是碳元素,根据“D+与C3-具有相同的电子层结构”,可以得到D是Na,C是氮元素,因为A、D同主族,只有D是金属,因此A是氢元素,C、E同主族,得到E是磷元素,因此
A:NO不能与碱反应
B:最高价氧化物的水化物为碳酸,是弱电解质
C:NH3+HNO3=NH4NO3
D:钠离子的半径大于氮离子的半径
本题难度:一般
4、选择题 下列各组元素中原子序数按由小到大顺序排列的是:
A.? Be、C、B? B.? Li、O、Cl? C.? Al、S、Si? D.? C、S、Mg
参考答案:B
本题解析:略
本题难度:简单
5、填空题 有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大。,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍;,B是地壳中含量最多的元素;C元素的焰色为黄色,C的单质一般保存在煤油中;D的M层电子数为K层电子数的3倍。试根据以上叙述回答:
(1)元素名称:A ________ B __________ C __________ D ___________。
(2)写出A与B形成的化合物的电子式:______________。
(3)画出D的离子结构示意图: ___________________。
(4)B的气态氢化物稳定性比D的气态氢化物稳定性______。(填“强”、“弱”或“相同”)
(5)已知4g A的气态氢化物在氧气中完全燃烧生成液态水,放出222.5kJ热量。写出A的氢化物燃烧的热化学方程式?。
参考答案:(1)碳;氧;钠;硫(2)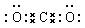 (3)
(3)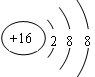 (4)强
(4)强
(5)? CH4(g)+2O2(g)=CO2(g)+2H2O(l)?△H= -890kJ/mol
本题解析:A的L层电子数是K层电子数的两倍,则A是碳元素。地壳中含量最多的元素是氧元素,则是B氧元素。焰色反应是黄色的是钠元素,所以C是钠元素。D的M层电子数为K层电子数的3倍,所以D是硫元素。
(2)CO2是由极性键形成的共价化合物,电子式为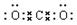 。
。
(3)硫离子的核外电子数是18,其结构示意图为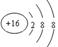 。
。
(4)第ⅥA自上而下非金属逐渐减弱,相应氢化物的稳定性也逐渐减弱,所以水的稳定性其余硫化氢的。
(5)4g A的气态氢化物在氧气中完全燃烧生成液态水,放出222.5kJ热量,则1mol甲烷完全燃烧放出的热量是222.5kJ×16÷4=890kJ,所以热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)?△H= -890kJ/mol。
本题难度:一般