| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《弱电解质电离平衡》高频考点巩固(2017年模拟版)(二)
该混合溶液中离子浓度由大到小的顺序是?。 (4)丁组实验所得混合溶液中由水电离出的 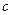  =?mol·L-1。 =?mol·L-1。参考答案:(每小题3分)(1)>?(2)C?(3)弱? Na+>A->OH->H+?(4)10-5 本题解析:(1)若HA是弱酸,则恰好反应后是强碱弱酸溶液,呈碱性。(2)、根据电荷守恒有:c(Na+)+c(OH-)=c(H+)+c(A-) ,pH=7时,c(OH-)=c(H+),所以c(Na+)= c(A-)。 本题难度:一般 3、选择题 体积相同,pH相同的 ①稀盐酸 ②稀硫酸 ③稀醋酸,分别用同物质的量浓度的NaOH溶液完全中和时,所消耗的NaOH溶液的体积关系正确的是 |
参考答案:D
本题解析:体积相同,pH相同的 ①稀盐酸 ②稀硫酸 ③稀醋酸,因为稀醋酸是弱酸,部分电离,故醋酸的物质的量浓度最大,故等体积消耗的NaOH溶液的体积最多;pH相同的 ①稀盐酸 ②稀硫酸,两者均为强电解质,c(H+)相同,故消耗NaOH溶液的体积相同,故D项正确。
考点:弱电解质电离。
本题难度:一般
4、选择题 下列说法中,能说明酸HA的酸性比酸HB的酸性强的是
A.同温、同浓度的钠盐溶液PH:NaA>NaB
B.PH相同的HA,HB的酸溶液,稀释相同倍数后,PH:HA<HB
C.中和等体积、等PH的HA,HB溶液时,HA消耗NaOH的物质的量多
D.同温、同浓度的两种酸溶液,HA的电离程度大于HB的电离程度
参考答案:D
本题解析:A.根据“越弱越水解”可知,NaA水解程度大,故HA的酸性弱。A错误。
B.PH相同的酸溶液,稀释相同倍数,酸性越弱的溶液PH增大的越小,故HA的酸性弱,B错误。
C.中和等体积、等PH的HA,HB溶液时,HA消耗NaOH的物质的量多,说明HA的浓度大,电离程度小,酸性弱,C错误。
D.同温、同浓度的两种酸溶液,电离程度越大酸性越强,故HA的酸性强,D正确。
故选D
本题难度:一般
5、选择题 把0.05mol NaOH固体分别加入到100mL下列溶液中,溶液的导电能力变化最小的是
A.自来水
B.0.5mol·L-1盐酸
C.0.5mol·L-1醋酸溶液
D.0.5mol·L-1KCl溶液
参考答案:B
本题解析:溶液的导电能力只与溶液中离子的浓度及电荷数有关系。氢氧化钠溶于水,导电能力增强,A不正确;氢氧化和盐酸反应,氢离子浓度减少,氮钠离子浓度增大,且氯离子浓度不变,所以导电能力变化最小;醋酸是弱酸,和氢氧化钠反应生成强电解质醋酸钠,导电能力增强;D中氯化钾和氢氧化钠不反应,阴阳离子的浓度的浓度增加,导电能力增强,答案选B。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《电解质溶液.. | |