微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 甲、乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10 mL 0.1 mol·L-1 AlCl3溶液,两烧杯中都有沉淀生成。下列判断正确的是
[? ]
A.甲中沉淀一定比乙中的多
B.甲中沉淀一定比乙中的少
C.甲中沉淀可能比乙中的少
D.甲中和乙中的沉淀可能一样多
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列关于电解质溶液的叙述正确的是(? )
A.常温下,由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在:BOH B++OH-
B++OH-
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
参考答案:A
本题解析:A项,常温下,0.1 mol/L的一元碱的pH=10表明该一元碱是弱碱,在溶液中不能完全电离;根据电荷守恒,B项正确的表达式应为:c(Cl-)=c(NH4+)>c(H+)=c(OH-);C项醋酸是弱酸,消耗的NaOH较多;根据水的离子积常数可知,盐酸稀释后,OH-浓度逐渐增大。
本题难度:一般
3、选择题 在体积均为1 L,pH均等于2的盐酸和醋酸中,分别投入0.12 g镁粉充分反应后,下图中比较符合反应事实的曲线是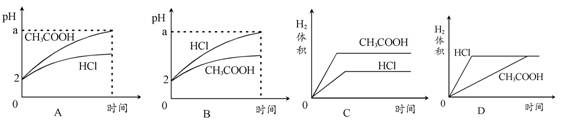
参考答案:B
本题解析:略
本题难度:简单
4、填空题 在相同条件下进行Mg和酸反应的对应实验,相关数据如下:
?
| 镁的质量
| 酸量
| 开始的反应速率
| 产生H2总量
|
Ⅰ
| 0.24g
| HCl:? 0.2 mol/L 100mL
| ν1
| n1
|
Ⅱ
| 0.24g
| CH3COOH:0.2 mol/L 100mL
| ν2
| n2
|
(1)试比较有关量的大小:ν1 ??ν2、n1 ??n2 (填“﹥”“=”“﹤”)
(2)现欲改变条件,使实验Ⅰ中ν1降低,但不改变n1的值,试写出两种可行的方法:
①??②?
参考答案:(1)ν1?﹥?ν2;n1=?n2(2)①?加水稀释?
②?加入少量醋酸钠固体或降温。
本题解析:(1)弱酸是部分电离,同浓度的情况下,自由移动的H+浓度小,开始的反应速率必然小。但二者的反应结束后,镁均过量,酸均不足,其中的H+必然都被置换出来,所以n1=?n2;
(2)使实验Ⅰ中ν1降低,只要降低H+的浓度即可,但总量不能改变。所以可以加入醋酸钠固体或可以降低温度使醋酸的电离平衡左移。
本题难度:一般
5、选择题 下列事实中,能说明MOH是弱碱的有
①0.1mol/LMOH可以使酚酞试液变红
②0.1mol/LMCl溶液的呈酸性
③0.1mol/LMOH溶液的导电性比0.1mol/LNaOH溶液弱
④等体积的0.1mol/LMOH溶液与0.1mol/LHCl溶液恰好完全反应
A.①②③
B.②③
C.②④
D.③④
参考答案:B
本题解析:①0.1mol/L MOH可以使酚酞试液变红,说明 MOH溶液呈碱性,而不能说明 MOH的电离程度,不能证明 MOH是弱电解质,错误;②0.1mol/L的MCl溶液的呈酸性,说明MCl为强酸弱碱盐,M+离子水解而导致溶液呈酸性,则MOH为弱电解质,正确;③0.1mol/L MOH溶液的导电性比0.1mol/L NaOH溶液弱,说明 MOH溶液中离子浓度较小, MOH部分电离,正确;④等体积的0.1mol/L MOH溶液与0.1mol/L HCl溶液恰好完全反应,无论是强碱还是弱碱,都恰好完全反应,错误;选B。
本题难度:一般