微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (15分)已知NaHCO3低温时溶解度小。德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱。此过程可以表示为:
①NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
②2NaHCO3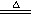 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和。
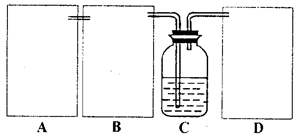
(1)制CO2时为了使反应随开随用,随关随停,上图A方框内应选用以下_________装置(填序号)。简述该装置能随关随停的理由________________。
(2)为使实验能够进行,在B、D方框内补上所需装置:_________________(将装置图画在答题卡上),并指明所用试剂:_________________。
(3)该小组同学按正确的方法连接装置,检验气密性合格后进行实验,发现析出的晶体非常少。老师的指导下,他们对某个装置进行了改进,达到了实验目的。你认为他们的改进方法是___________________。
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为______________。
参考答案:(1)③(1分),关闭弹簧夹后反应生成的气体使上部压强增大,到达一定程度后可把反应液压回漏斗,使固液分离从而停止反应?(2分)
(2)试剂:饱和碳酸氢钠溶液?试剂:稀硫酸或水(画图2分,试剂1分,共6分)

(3)将C装置浸泡在一个盛有冰水混合物的水槽里(或大烧杯中)(3分)
(4)65%(3分)
本题解析:(1)实验室制取二氧化碳一般采用块状大理石和盐酸反应,要使反应随开随用,随关随停,关键是使固体和溶液分离才能到达目的,故一般采用简易启普发生器,即装置③。原因是关闭弹簧夹后反应生成的气体使上部压强增大,到达一定程度后可把反应液压回漏斗,使固液分离从而停止反应。
(2)因为生成的二氧化碳气体混有氯化氢气体,再通入到C之前要先除杂,试剂选用饱和的碳酸氢钠溶液。由于氨气极易溶于水,所以为了防止倒吸,需要加入1个防倒吸的装置,试剂可以是水或者稀硫酸。
(3)因为NaHCO3低温时溶解度小,所以要大量析出,需要降低溶液的温度。
(4)NaCl的质量为5.85g,所以根据原子守恒可知理论上应得到8.4g碳酸氢钠。由于第二步分解时没有损失,所以Na2CO3的产率是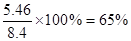 。
。
本题难度:一般
2、实验题 实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备
MgAl2O4,主要流程如下
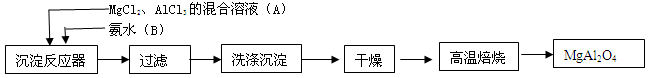
(1)为使Mg2+、Al1+同时生成沉淀,应先向沉淀反应器
中加入________(填“A”或“B”),再滴加另一反应物。
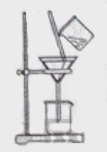
(2)如右图所示,过滤操作中的一处错误是________。
(3)判断流程中沉淀是否洗净所用的试剂是________。高温焙烧时,用于盛放固体的仪器名称是________。
(4)无水AlCl3(183°C升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
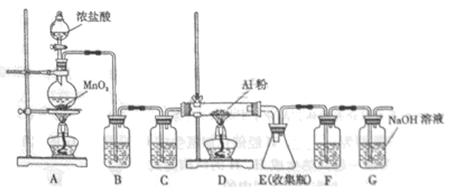
装置 B中盛放饱和NaCl溶液,该装置的主要作用是______。F中试剂的作用是__________。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为__________。
参考答案:(1)B?(2)漏斗末端没有紧靠烧杯内壁?(3)氨水?坩埚?(4)除去氯气中HCl?防止水蒸气进入E?碱石灰
本题解析:(1)Mg2+、Al3+同时生成沉淀,则先加入氨水。(2)过滤时漏斗末端没有紧靠烧杯内壁。(3)检验沉淀是否洗净可向洗涤液中加入氨水,观察是否有沉淀产生。高温焙烧在坩埚中进行。(4)装置B中饱和NaCl溶液用于除去氯气中HCl,F盛装浓硫酸,防止水蒸气进入E。用干燥管盛装碱石灰可以起到F和G的作用。
【考点定位】化学实验,装置图识别,基本操作等。
本题难度:一般
3、选择题 为了更简便地制取干燥的NH3,下列方法中适合的是
A.NH4Cl与浓H2SO4混合共热,生成的气体用碱石灰进行干燥
B.N2+3H2 ,用烧碱进行干燥
,用烧碱进行干燥
C.加热浓氨水,气体用碱石灰干燥
D.加热NH4HCO3,气体用P2O5干燥
参考答案:C
本题解析:略
本题难度:简单
4、实验题 工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下:
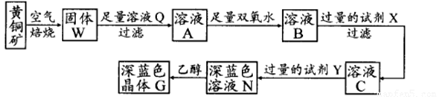
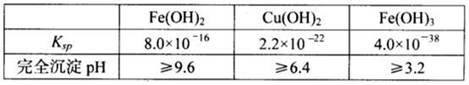
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,写出其反应的化学方程式?;
(2)试剂X的化学式为??,双氧水的作用是?;
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为?,用pH试纸测该溶液pH值的方法是?;
(4)在溶液N中加入乙醇的目的是?。
参考答案:(1)2CuFeS2+O2 Cu2S+2FeS+SO2
Cu2S+2FeS+SO2
(2)CuO或合理答案;将Fe2+氧化为Fe3+
(3)10-5;用洁净的玻璃棒蘸取待测液点在pH试纸的中央,并与比色卡比色
(4)降低晶体溶解度,有利于晶体析出
本题解析:(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,即Cu2S和2FeS,由S元素守恒,S元素有多余,与O2结合为SO2。
(2)含中含有氧Fe2+,加入双氧水的目的就是把Fe2+氧化为Fe3+,B溶液含Cu2+和Fe3+,为了除去Fe3+,可以降低溶液的pH至3.2到6.4之间,试剂X的化学式为CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3等;
(3)试剂Y是氨水,0.1 mol/L时pH=11,c(OH-)≈c(NH4+)=10-3;NH3·H2O的电离常数为K=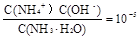 ;
;
(4)用pH试纸测该溶液pH值的方法是用洁净的玻璃棒蘸取待测液点在pH试纸的中央,并与比色卡比色;在溶液N中加入乙醇的目的是降低晶体溶解度,有利于晶体析出。
本题难度:一般
5、选择题 光卤石是化工生产中一种重要的中间产物,其化学成分是KCl·MgCl2·6H2O。当用光卤石为原料制取金属镁时,一共有下列几步:①过滤②溶解?③加入适量Ca(OH)2④蒸发⑤用盐酸溶解⑥电解熔融MgCl2⑦在HCl气流中强热MgCl2·6H2O晶体,正确的顺序是(? )?
A.⑤③①②④⑥⑦
B.②③①⑤④⑦⑥
C.②④①③⑦⑤⑥
D.⑤③①④②⑦⑥
参考答案:B
本题解析:提纯光卤石得到MgCl2的步骤为:先将光卤石溶解于水,因为KCl、MgCl2均易溶于水,故沉淀Mg2+;结合Mg(OH)2的溶解度比Ca(OH)2更小,故加入适量的Ca(OH)2过滤后得Mg(OH)2沉淀,洗涤后溶于适量的盐酸发生反应:Mg(OH)2+2HCl==MgCl2+2H2O,蒸发溶液得MgCl2·6H2O,由于加热MgCl2·6H2O的过程中,会有部分MgCl2又与H2O反应生成Mg(OH)2,该反应可逆:MgCl2+2H2O Mg(OH)2+2HCl;根据平衡移动原理,在HCl气流中加热MgCl2·6H2O,使MgCl2与H2O的反应得到抑制,故能得到纯净的MgCl2。
Mg(OH)2+2HCl;根据平衡移动原理,在HCl气流中加热MgCl2·6H2O,使MgCl2与H2O的反应得到抑制,故能得到纯净的MgCl2。
本题难度:简单