微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 右图装置可用于

A.加热NaHCO3制CO2
B.用Cu与稀HNO3反应制NO
C.用NH4Cl与浓NaOH溶液反应制NH3
D.用NaCl与浓H2SO4反应制HCl
2、选择题 向一种溶液中滴加另一种溶液,溶液的颜色有明显变化的是
A.硫酸亚铁溶液中滴加硫氰化钾溶液
B.稀醋酸溶液中滴加酚酞指示剂
C.硫酸铜溶液中滴加硝酸钡溶液
D.溴水中滴加亚硫酸钠溶液
3、实验题 在实验室里用乙醇和浓硫酸反应生成乙烯,再用溴与乙烯反应生成1,2-二溴乙烷,可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。有关数据列表如下:
?
| 乙醇
| 1,2二溴乙烷
| 乙醚
|
状态
| 无色液体
| 无色液体
| 无色液体
|
密度/g·cm-3
| 0.79
| 2.2
| 0.71
|
沸点/℃
| 78.5
| 132
| 34.6
|
熔点/℃
| -130
| 9
| -116
|
(1)用下列仪器制备1,2-二溴乙烷。如果气体流向为从左到右,则正确的连接顺序是(短接口或橡皮管均已略去): 经A(1)插入A中, 接A(2),A(3)接 接 接 接 (填大写字母代号)。

(2)温度计水银球的正确位置是 。
a、支管口处? b、液面上方 c、液面以下
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a、水 b、氢氧化钠溶液 c、碘化钠溶液 d、乙醇
(6)若产物中有少量副产物乙醚,可用 的方法除去;
(7)反应过程中应用冷水冷却装置E,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
4、计算题 过二硫酸钾(K2S2O8)是一种无色结晶,不溶于乙醇,有强氧化性,易分解。实验室制备过二硫酸钾可通过低温电解KHSO4认溶液得到。
实验步骤如下:
步骤1.称取40gKHSO4溶解90mL蒸馏水,倒入大试管,试管浸在冰水浴中(装置见图9),并冷却到5℃以下。
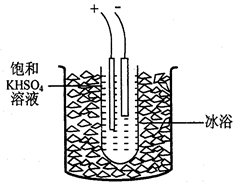
步骤2电解2h,每隔约半小时补一次冰
步骤3.将沉淀收集在漏斗中,直接用乙醇和乙醚洗涤和过滤
步骤4.干燥、称重
步骤5.回收乙醚和乙醇
(1)电解总反应的化学方程式为?。
(2)电解过程中,阳极产生微量且能使湿润的KI-淀粉变蓝的有色单质气体,该气体可能是(填化学式)。
(3)步骤2每隔半小时要向大烧杯添加冰块,其原因是?。
(4)步骤5回收乙醇、乙醚时采用的操作方法是?。
(5)取得到的样品0.2500g溶于30mL水,加4gKI,塞住瓶塞,振荡,静止15min,加入1mL冰醋酸,再用cmol·L- 1Na2S2O3溶液滴定。(S2O82- +3I- =2SO42- +I3-;I3- I2+I-;2S2O32-+I2=2I- + S4O62-)
I2+I-;2S2O32-+I2=2I- + S4O62-)
①溶解时,加入KI后需塞住瓶塞,其目的是?。
②本实验所用的指示剂为?。
③若本次滴定消耗Na2SO3溶液VmL,由本次结果计算,样品中K2S2O8的纯度为(用含c、V的代数式表示)。
(6)分析化学上检验Mn2+在Ag+催化下K2S2O8溶液将Mn2+氧化为紫色的MnO4-,该反应的离子方程式为 。
5、实验题 (10分)某研究性学习小组利用如图所示装置完成有关实验。
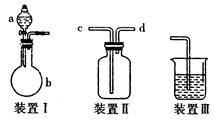
【实验一】快速制氨气
(1)用装置I快速制氨气,则装置I的a仪器中可加入浓氨水,b仪器中加入?。装置Ⅱ从?管口进气可作为氨气的收集装置。
【实验二】收集NO
(2)利用装置Ⅱ可收集NO,试简述操作方法:?。
【实验三】比较硫、碳、硅三种元素的非金属性强弱
(3)设计实验,完成下列表格(可以不填满,也可以再加行)