微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (8分)用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③稀释、降温;④转移、洗涤;⑤定容、摇匀。回答下列问题
(1)所需浓硫酸的体积是? ?;
?;
(2)第⑤步实验的具体操作是??
? ?。
?。
(3)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.容量瓶用蒸馏洗涤后残留有少量的水?
B.所用过的烧杯、玻璃棒未洗涤?
C.定容时俯视溶液的液面?
参考答案:(1)16.7ml (2分)?
(2)继续向容量瓶注入蒸馏水至离刻度线1-2cm处(1分),改用胶头滴管向容量瓶滴加至液凹面与刻度线相切为止(1分)。塞紧瓶塞,倒转摇匀。(1分)
(3)A. 无影响(1分)? B. 偏小(1分)? C. 偏大(1分)
本题解析:略
本题难度:一般
2、实验题 写出实验室由苯和浓硝酸反应制取硝基苯的化学方程式:
?该反应属于?反应。
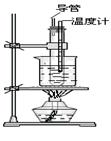
(2)右图所示的实验装置图中存在哪些错误?请指正。
①?;
②?;
③?。
(3)水浴加热有哪些优点??;
在试管中将两种浓酸混和的操作方法是?。
参考答案:(14分)
(1)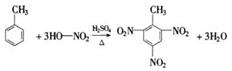 ?取代反应?
?取代反应?
(2)温度计应插入烧杯中的热水中?直导管不够长?试管不能碰到烧杯底部?
(3)受热均匀便于控制温度?先取一定量的浓硝酸,然后沿器壁慢慢注入浓硫酸,边加边振荡
本题解析:(1)在浓硫酸的作用下,苯和浓硝酸发生硝化反应生成硝基苯,反应的化学方程式是 ,该反应也是取代反应。
,该反应也是取代反应。
(2)该反应是水浴加热,所以温度计应插入烧杯中的热水中,且试管不能碰到烧杯底部;苯易挥发,则直导管兼起冷凝和回流作用,显然直导管不够长。
(3)采用水浴加热能使受热均匀且便于控制温度;浓硫酸的密度大于硝酸的,且浓硫酸溶于水放热,所以在试管中将两种浓酸混和的操作方法是先取一定量的浓硝酸,然后沿器壁慢慢注入浓硫酸,边加边振荡。
点评:该题是基础性试题的考查,也是高考中的常见考点。试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,难度不大。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
3、选择题 下列各组气体中,在通常情况下既能用浓硫酸又能用碱石灰干燥的有
[? ]
A.CO、O2、N2
B.HCl、Cl2、CO2
C.CH4、H2、CO
D.SO2、Cl2、O2
参考答案:AC
本题解析:
本题难度:一般
4、推断题 (12分) 以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:

(1)图中“沉铁”化学方程式为?。
(2)图中“过滤”后滤液中金属阳离子除了含有的Al3+,还含有??(填化学式)。
(3)加30%的H2O2溶液发生的离子反应方程式为?。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O] 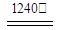 2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过图9所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过图9所示的装置。


①集气瓶中收集到的气体是??(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有??(填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为?。
参考答案:(1)2K4[Fe(CN)6]+ Fe 2(SO4)3 = 2KFe[Fe(CN)6]↓+3K2SO4(2分)
(2)Fe2+ Fe3+(2分)
(3)2Fe2++H2O2+2H+ = 2Fe3++2H2O(2分)
(4)①N2(2分)②SO3、NH3(2分,缺漏不给分)。
③2MnO4- +5SO2 + 2H2O = 2Mn2+ + 5SO42-+4H+(2分)
本题解析:(1)由K4[Fe(CN)6]生成KFe[Fe(CN)6];(2)铁的氧化物和氧化铝溶于酸,二氧化硅不溶形成滤渣;(3)溶液中的亚铁离子不易除去,需把其氧化为铁离子再沉淀除去;(4)①通过饱和亚硫酸氢钠溶液除去氨气、三氧化硫,通过高锰酸钾溶液除去二氧化硫气体,故收集的气体为氮气;②SO3、NH3均溶解于水与水反应;③KMnO4溶液与二氧化硫反应,二氧化硫被氧化为硫酸根离子。
本题难度:一般
5、选择题 下列实验不能达到预期目的的是
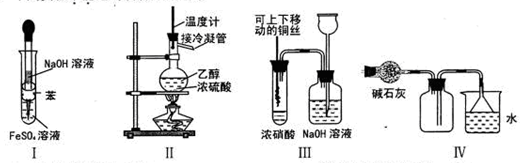
A.利用I制取Fe(OH)2
B.利用II装置制取CH2=CH2
C.利用III装置进行铜与浓硝酸反应的实验
D.利用IV装置收集NH3
参考答案:B
本题解析:苯不溶于水,密度比水小,则试管中溶液分层,位于上层的苯能隔绝空气,防止硫酸亚铁溶液氧化,将盛有NaOH溶液的长胶头滴管深入位于下层的硫酸亚铁溶液中,二者不仅能发生复分解反应,生成白色的氢氧化亚铁沉淀和硫酸钠溶液,而且能防止空气中的氧气将氢氧化亚铁氧化为氢氧化铁,故A项能达到实验目的;常温常压下乙醇是液体,在浓硫酸作用下,混合溶液加热到170℃时发生消去反应,生成乙烯,若混合溶液加热到140℃时发生取代反应,生成乙醚和水,因此温度计地水银球必须伸入乙醇和浓硫酸的混合液中,蒸馏时温度计水银球才能与蒸馏烧瓶支管口相平,故B项不能达到实验目的;浓硝酸与氢后金属铜接触时容易发生氧化还原反应,生成硝酸铜、二氧化氮和水,因此试管和集气瓶内出现红棕色气体,使铜丝离开液面时,反应停止,由于二氧化氮有毒,需要用NaOH溶液吸收多余的二氧化氮,二者发生氧化还原反应,生成硝酸钠、亚硝酸钠和水,空气沿长颈漏斗的长管进入集气瓶中,可以防止倒吸,故C项能达到实验目的;氨气是碱性气体,通常用碱性干燥剂除去其中混有的水分,氨气的密度比空气小,极易溶于水,因此不能排水法收集,只能用向下排空气法收集,图中氨气短进长出能干走集气瓶内的空气,多余氨气用水吸收时需要防止倒吸,倒扣漏斗的口与水面相平,既能充分吸收氨气,又能防止倒吸,故D错误。
本题难度:一般