| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》高频试题巩固(2017年最新版)(四)
参考答案:D 本题解析:NaF是强碱弱酸盐,水解显碱性,溶液中有H2O和HF两种分子。NH4Cl是强酸弱碱盐,水解显酸性,溶液中有H2O和NH3·H2O两种分子。HClO是弱酸,存在电离平衡,溶液中有H2O和HClO两种分子。硝酸是强酸,在溶液中全部电离,只有水分子。所以答案选D。 本题难度:一般 2、填空题 (12分)已知二元酸H2A在水中存在以下电离:H2A===H++HA-,HA- |
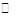 Ca2+(aq)+A2-(aq) ΔH>0。一定温度下向浊液中通入HCl气体,c(Ca2+) (填“减小”、“增大”或“不变”),原因是 。
Ca2+(aq)+A2-(aq) ΔH>0。一定温度下向浊液中通入HCl气体,c(Ca2+) (填“减小”、“增大”或“不变”),原因是 。参考答案:(1)酸 HA-只电离不水解 (2)B
(3)增大 H+与A2-结合为HA-,使平衡右移,c(Ca2+)增大 (4)2.5×10-10 mol/L
本题解析:(1)由于H2A===H++HA-,所以HA-只电离不水解,故溶液呈酸性;(2) )某温度下溶液呈中性,PH不一定为7;溶液呈中性c(OH-)=" c" (H+),所以水的离子积Kw=c2(OH-);10 mL 0.1 mol·L-1 NaHA溶液中加入10 mL 0.1 mol·L-1 KOH溶液,恰好完全反应生成Na2A,由于A2—水解,溶液呈碱性,要使溶液呈中性,加入氢氧化钾的体积小于10mL;所以c(K+) <c(Na+),故B正确;(3) A2-+H+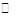 HA-,加入盐酸,A2-减少,CaA(s)
HA-,加入盐酸,A2-减少,CaA(s)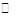 Ca2+(aq)+A2-(aq),平衡正向移动,故c(Ca2+)增大;(4) c(Ca2+) c(A2-)= 2.0×10-11,c(Ca2+)=0.08 mol·L-1,所以c(A2-)= 2.5×10-10 mol/L。
Ca2+(aq)+A2-(aq),平衡正向移动,故c(Ca2+)增大;(4) c(Ca2+) c(A2-)= 2.0×10-11,c(Ca2+)=0.08 mol·L-1,所以c(A2-)= 2.5×10-10 mol/L。
考点:本题考查化学试剂的标志。
本题难度:一般
3、选择题 比较下列溶液的pH (填“>”、“<”、“=”)
(1)25℃、1mol/LFeCl3溶液_____80℃、1mol/LFeCl3溶液;
(2)0.1mol/L(NH4)2CO3溶液______0.1mol/L Na2CO3溶液。
(3)0.1mol/LNH4Cl溶液______0.01mo1/L NH4Cl溶液;
(4)0.1mol/LNa2CO3溶液______0.1mol/L NaHCO3溶液;
A > < < > B > > > > C < > < > D < < > >
参考答案:A
本题解析:加热促进水解,所以(1)后者的酸性强;NH4+水解显酸性,所以(2)中后者的碱性强;氯化铵的浓度越大,水解程度越小,但酸性越强,因此(3)中前者的酸性强;碳酸钠的水解程度大于碳酸氢钠的,所以(4)中前者的碱性强,答案选A。
本题难度:一般
4、选择题 25℃,pH=3的醋酸溶液(I)和pH=ll的氢氧化钠溶液(II),下列说法正确的是( )
A.I和II中H2O的电离程度不相等
B.将I稀释l0倍,溶液中c(CH3COOH)、c(OH
参考答案:
本题解析:
本题难度:一般
5、选择题 常温下,下列离子浓度的关系正确的是
A.pH=2的盐酸与pH=12的氨水等体积混合:c(NH4+)=c(Cl-)>c(H+)=c(OH-)
B.0.2 mol·L-1的CH3COONa溶液与0.1 mol·L-1的HCl等体积混合:c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-)
C.0.1 mol·L-1的HCN(弱酸)和0.1 mol·L-1的NaCN等体积混合:c(HCN)+c(CN-)+c(OH-)=c(Na+)+c(H+)
D.相同物质的量浓度时,溶液中c(NH4+)由大到小的顺序:NH4Al(SO4)2>NH4Cl>CH3COONH4>NH3·H2O
参考答案:D
本题解析:A.pH=2的盐酸与pH=12的氨水,氨水浓度大于HCl,二者等体积混合,氨水剩余,溶液呈碱性,所以c(H+)<c(OH-),根据电荷守恒得c(NH4+)>c(Cl-),错误;B.0.2 mol?L-1的CH3COONa溶液与0.1 mol?L-1的HCl等体积混合,溶液中的溶质是等物质的量浓度的CH3COONa、NaCl和CH3COOH,CH3COOH的电离程度大于醋酸根离子水解程度,溶液呈酸性,c(H+)>c(OH-),醋酸电离程度大于醋酸根离子水解,所以c(Cl-)<c(CH3COO-),错误;C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(CN-)+c(OH-)=c(Na+)+c(H+),错误;D.铝离子抑制铵根离子水解、醋酸根离子促进铵根离子水解、一水合氨电离程度较小,所以相同浓度的这几种溶液中,盐完全电离、一水合氨部分电离,抑制铵根离子水解的溶液中铵根离子浓度大于促进水解的溶液,则这几种溶液中铵根离子浓度大小顺序是NH4Al(SO4)2>NH4Cl>CH3COONH4>NH3?H2O,正确。
考点:考查离子浓度大小比较。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《反应速率与.. | |