| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》高频试题巩固(2017年最新版)(六)
参考答案:A 本题解析: (NH4)2SO4是强电解质,完全电离, c(NH4+)接近 c(SO42-)的二倍, 铵根离子水解消耗水电离产生的 OH-,所以 c(H+)>c(OH-);但是盐的水解程度是微弱的,盐的电离远大于弱电解质水的电离,因此c(H+)、c(OH-)都比较小,故:c(NH4+)> c(SO42-)>c(H+)>c(OH-),答案选A。 本题难度:一般 4、选择题 等物质的量浓度的下列溶液中,NH4+离子的浓度最大的是( ) |
参考答案:C
本题解析:NH4+在水溶液中发生水解反应:NH4++H2O 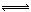 NH3?H2O+H+,水解程度越小,NH4+的浓度就越大,NH4HSO4为强酸的酸式盐,电离产生的H+抑制NH4+的水解,NH4Cl、NH4NO3没有其他离子影响,NH4HCO3为弱酸的酸式盐,显碱性,促进NH4+的水解,故NH4HSO4中NH4+浓度最大,C项正确。
NH3?H2O+H+,水解程度越小,NH4+的浓度就越大,NH4HSO4为强酸的酸式盐,电离产生的H+抑制NH4+的水解,NH4Cl、NH4NO3没有其他离子影响,NH4HCO3为弱酸的酸式盐,显碱性,促进NH4+的水解,故NH4HSO4中NH4+浓度最大,C项正确。
考点:本题考查盐类的水解。
本题难度:一般
5、选择题 常温下,将a mol/L的MOH(可溶性弱碱)与b mol/L盐酸等体积混合,已知相同条件下MOH的电离程度大于M+的水解程度,则下列有关推论不正确的是( )
A.若混合后溶液pH=7,则c(M+)=c(Cl-)
B.若b=2a,则c(Cl-)>c(M+)>c(H+)>c(OH-)
C.若a=2b,则c(M+)>c(Cl-)>c(OH-)>c(H+)
D.若混合后溶液满足c(H+)=c(OH-)+c(MOH),则可推出a=b
参考答案:B
本题解析:根据溶液的电中性原理可知A项正确;若b=2a,混合后的溶液为等物质的量浓度的MCl和HCl的混合溶液,M+离子部分水解,故c(H+)>c(M+),B项错误;若a=2b,混合后的溶液为等物质的量浓度的MCl和MOH的混合溶液,因MOH的电离程度大于M+的水解程度,故c(OH-)>c(H+),MOH的电离是微弱的,故c(Cl-)>c(OH-),C项正确;若b=a,混合后的溶液为MCl溶液,根据质子守恒可知c(H+)=c(OH-)+c(MOH),D项正确
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《反应速率与.. | |